Fechamento 12:00 – 28/06/02
28 de junho de 2002Comparação de algumas características qualitativas da carne de animais em diferentes sistemas de terminação
28 de junho de 2002Ácido Linoleico Conjugado, gordura produzida por bovinos e seus efeitos para saúde
Por Marcelo de Queiroz Manella e Felipe Tonato
1 -Introdução
Nos países do chamado “Mundo Desenvolvido” a preocupação com a saúde alimentar vem aumentando a cada dia, não apenas no que diz respeito a qualidade sanitária da alimentação, mas principalmente em relação aos possíveis efeitos (maléficos ou benéficos) de determinados alimentos ou nutrientes para a saúde dos consumidores. Nestes países a obesidade vem se tornando, de certa forma, uma epidemia, provocando aumento no consumo de alimentos com baixa gordura e menor densidade energética. Por outro lado pesquisas recentes demonstram que não só qualidade, mas também a quantidade de determinadas ácidos graxos devem ser considerados na dieta.
Dentre dos ácidos graxos, um em especial vem recebendo maior atenção, devido aos seus efeitos benéficos na saúde humana, o Ácido Linoleico Conjugado ou CLA, chegando a ser denominado pela mídia de a “boa gordura”.
O CLA é um ácido graxo poli-insaturado encontrado naturalmente nas gorduras de alimentos advindos de ruminantes (carne e leite)e seus derivados, especialmente de animais criados a pasto. O termo CLA refere-se a inúmeros isómeros que apresentam pequenas diferenças nas ligações químicas, porém os compostos que predominam são o cis 9 trans 11 e o trans 10 e cis 12, originados da biohidrogenação do Ácido Linoléico.
Apesar de o CLA já ser conhecido desde a década de 50, apenas em 1970 a comunidade científica passou a apresentar um maior interesse neste composto, quando de forma casual, um pesquisador chamado Michael Pariza que investigava efeitos mutagênicos em carne bovina preparada observou que compostos de carne grelhada ou crua modulavam a mutagênese no teste de Ames (Salmonella), mostrando acentuada atividade anti-mutagênica. Mais tarde o composto identificado foi o CLA. Desde então, trabalhos realizados por Pariza e colaboradores vem demonstrando os efeitos biológicos positivos do CLA.
Entretanto, em modelos animais tem-se observado ainda outros benefícios do CLA, como um potente anti-carcinogénico, ou mesmo in vitro com célula de tumores humanos, efeitos aterogénicos em coelhos e hamsters, alteração na partição de nutrientes favorecendo a deposição muscular em relação à gordura em animais e humanos.
A grande ironia é que o precursor do CLA, o Ácido Linoléico, apresenta efeitos contrários, sendo reconhecidamente uma substância que estimula o crescimento de células cancerígenas.
Com base nas evidências científicas, o objetivo do presente trabalho é apresentar uma breve síntese dos possíveis efeitos do CLA na saúde humana.
2 – Biossíntese e estrutura química
Dá-se a denominação de CLA a um grupo de isómeros posicionais e geométricos do ácido octadenóico (Linoleico), apresentando duas duplas ligações conjugadas a partir dos carbonos 9, 10 ou 11. Todas as configurações, cis-trans, trans-cis, cis-cis e trans-trans são possíveis em qualquer uma dos sistemas de posição da dupla ligação. Porém os isómeros cis-9 trans-11 e trans-10 cis-12 (Fig. 1) são os de maior abundância nos alimentos.
O ácido Linoléico é um ácido graxo poli-insaturado com 18 carbonos e duas duplas ligações nas posições 9 e 12 na configuração “cis” (mesmo lado), quimicamente chamado de ácido octadenóico- cis 9, cis 12. A biohidrogenação incompleta deste composto origina o CLA, que ocorre devido a ação de diferentes cepas de bactérias.
O principal isómero modulado no rúmen é o cis 9 trans 11 (Bauman e Kelly, 1997), que pode passar para o duodeno e ser absorvido, ou continuar sofrendo alterações, formando o ácido octadeníco-trans-11, que em permanecendo no rúmen, formará o ácido esteárico (C18:0). O ácido octadeníco-trans-11 após passagem para o duodeno pode se converter, nas células da glândula mamaria pela esteariacil-Coa desaturase (delta-9) em cis 9 trans 11 (fig 2). Sendo este a principal via para concentração do cis 9 trans 11 no leite das vacas (Pariza, 2001).
Fig. 1: Representação estrutural dos isomeros de CLA e seu precursor .

De acordo com Scollan et al. (2001) ao se comparar dietas com linhaça ou grão de soja com fontes de gordura para bovinos de corte, a primeira fonte apresentou maiores concentrações de cis-9 trans 11 no longissimus. Porém no ensaio de fluxo ruminal, não foi observados diferenças no fluxo duodenal de CLA e do trans-11 foram semelhantes entre linhaça e a soja, sugerindo que outras vias metabólicas pós rúmen podem ter originado esta diferença.
Fig. 2: Via metabólica proposta para biosíntese do cis 9 trans 11 (Chouinard, et al.).
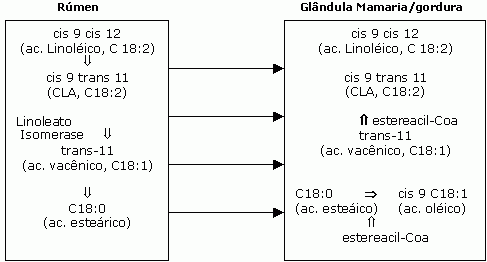
O isómero de CLA trans- 10 cis-12, também é encontrado na digesta ruminal, a partir da biohidrogenação do ácido linoléico. A transformação em ácido octadenóico trans-10 pode ocorrer, porém os mamíferos não apresentam a estereacil delta 12 desaturase, não podendo converter este composto em CLA trans- 10 cis-12. Portando o CLA trans- 10 cis-12 presente nos tecidos do ruminantes tem origem unicamente da biohidrogenação pelos microorganismos ruminais (Bauman et al. 1999, Pariza, 2001). As vias para formação de outros isomeros de CLA encontrados nos tecidos de ruminantes ainda são desconhecidas, mas é bem provável que estes tenham origem da biohidrogenação incompleta do metabolismo bacteriano no rúmen, porém as vias ainda são desconhecidas.
Parodi (1999) observou a existência de variações sazonais nas concentrações de CLA no leite das vacas, sendo que na primavera e verão eram significativamente maiores que no outono e inverno. Ou seja as maiores concentrações foram observadas no período em que as vacas estavam a pasto. Mais tarde, confirmou-se que as concentrações do CLA cis 9 trans 11 era o principal isómero da gordura do leite. Fatos estes recentemente confirmados por Stene (2001), onde o leite de vacas em sistemas de pastejo apresentaram maior concentração de CLA, que no leite de animais tratados no curral. Já French et al. (2000) observou que bovinos de corte apresentaram aumento nas concentrações de CLA no longissimus dorsi, conforme aumentou-se o consumo de pastagens.
A gordura de bovinos de corte alimentados com dieta controle, ou suplementados com 2% e 4% de óleo de soja, apresentaram 0,1, 1,2 e 1% de CLA trans- 10 cis-12 , respectivamente, enquanto as concentrações de cis 9 trans 11, permaneceram inalteradas (4; 4,1 e 4,6%, respectivamente), de acordo com Dhiman, et al. (1999.).
Estes resultados indicam que não só a concentração de CLA na gordura (leite ou de carne) podem ser alteradas, mas também as concentrações individuais de cada isómero podem ser afetados pela dieta.
Lock (2001) ao fornecer dietas para vacas leiteiras com diferentes concentrações de ácido linoléico (C18:2), ácido linolênico (C18:3), e suas combinações, observaram que tanto o C18:2 como o C18:3 provocaram aumento nas concentrações do CLA, quer pela maior produção no rúmen ou pela ação de delta 9-desaturase na glândula mamaria.
Outras espécies, tais como algumas aves podem produzir o CLA. Em perus por exemplo, observou-se teores consideráveis deste composto na carcaça. Mamíferos monogástricos, segundo alguns relatos, podem produzir CLA devido a fermentação íleo-cecal, como em suínos e equínos, porém a elevação do composto na gordura corpórea não é relatada, devido ao baixa capacidade absortiva do colon. Foi relatado por Yang (1997) que certas cepas de Lactobacillus reuteri do cólon de ratos podem converter ácido linoleico em CLA cis-9 trans-11.
Entretanto, Pariza (2001) relata que ao analisar soro sanguíneo comercial de equínos, observou níveis séricos elevados de CLA, sugerindo estudos mais específico em monogástricos.
3 – Síntese química
O objetivo da síntese química deve ser a de produzir CLA com características de máxima atividade biológica. A produção de CLA, de forma industrial envolve processos de transformação do ácido linoléico, que consiste principalmente em cis-9 trans-11 (40,8-41,1%) e trans-10 cis-12 (43,5-44,9%) para processos experimentais. Misturas comerciais de CLA apresentam outros isomeros com duplas ligações conjugadas nos carbonos 8,10 ou 11,13.
Para produção industrial realiza-se a isomerização do ácido linoléico, ativadas de processo de aquecimento em base forte (NaOH) em água, ou em hidróxido de potássio em propileno glicol. A utilização de hidróxido de sódio em água produz altas quantidades de trans- 8 cis-10 e cis-11 trans-13.
4 – CLA nos alimentos
A concentração de CLA nos alimentos apresentam uma grande variação. As concentrações relativas do CLA em uma grande variedade de alimentos são mostrados na tabela 1. De modo geral, é possível observar que as maiores concentrações são encontradas nos alimentos derivados de animais ruminantes.
Tabela 1: Teores de CLA em alguns alimentos.
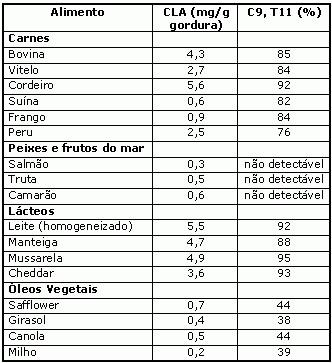
Alimentos de origem de ruminantes (carne e produtos lácteos) geralmente apresentam níveis de CLA entre 3 a 7 mg/g de gordura, que como discutido anteriormente pode ser elevado em função da dieta. Peixes, carne suína, e grande parte das aves e óleos vegetais apresentam quantidades de CLA pouco detectáveis.
5 – Efeitos fisiológicos
A maioria dos resultados referentes aos efeitos do CLA são realizados com modelos animais, como ratos coelhos e hamsters, ou in vitro com cultura de célula humanas, sendo os resultados extrapolados para espécie humana. Pesquisa com seres humanos ainda são escassas, porém alguns destes poucos resultados confirmam algumas das suposições dos modelos animais.
Inúmeros efeitos fisiológicos, incluindo a inibição química da carcinogênese em modelos animais, estimulo ao sistema imune enquanto diminui seus efeitos catabólicos em aves e roedores, diminuição da aterosclerose em coelhos e hamsters, maior crescimento em ratos e porcos, e diminuição do tecido gorduroso em ratos, suínos, cães e principalmente em humanos.
Tais efeitos são atribuídos ao CLA, mais precisamente ao isómeros c9-t11 e t10-c12. Segundo Pariza (2001) evidências confirmam que estes efeitos biológicos são em função de ações separadas destes isômeros. Alguns efeitos podem ser induzidos ou estimulados por ações sinérgicas destes compostos.
6 – Metabolismo e modulação de lipídios
Um dos efeitos do CLA parece ser sua influência na composição corporal, ou seja, nos teores de gordura corporal e proporção de tecido magro, especialmente em animais jovens em crescimento. O CLA induz a diminuição na deposição de gordura e aumenta a proporção de tecido magro.
Cook at al. (1998) realizou um primeiro trabalho com suínos alimentados com CLA. Neste ensaio observou-se redução de 20% no toucinho e aproximadamente 7% de aumento no tecido magro.
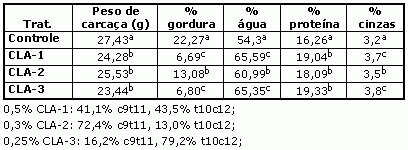
Park et al. (1999) demonstrou que o CLA poderia causar alterações na composição corporal. Trabalhando com ratas, forneceram dietas controles ou dieta contendo 0,5, 0,3 e 0,25% de CLA, com diferentes concentrações entre c9-t11 e t10-c12. O estudo indicou que a suplementação com CLA reduziu significativamente a gordura corporal, e aumentou a proporção de tecido magro em relação ao controle (tabela 2). Porém a magnitude da redução da gordura foi maior que o aumento na proteína.
Tabela 2: Efeitos do CLA na composição corporal de ratos.
Existem evidencias de efeitos semelhantes na gordura do leite quando o CLA é fornecido para bovinos. Medeiros et al. (2000) ao forneceu CLA protegido a vacas leiteiras a pasto, observou que além da maior concentração do composto no leite, houve também uma acentuada diminuição na gordura do leite, e um sensível aumento na produção de proteína láctea.
E trabalhos in vitro com células adiposas de ratos, a adição de CLA reduziu significativamente a atividade da lipase lipoprotéica (LPL), a qual reduziria a captação do ácido graxo e conseqüentemente diminuiria as concentrações de triacilglicerol no interior das células, estimulando a atividade da carnitina palmitoiltransferase (CPT) no músculo (Park et al., 1999). Esta última ocorrência aumentaria a -oxidação do tecido, impedindo o acumulo de triacilglicerol no adipócito, provavelmente estimulando a lipólise (Willians, 2000). O tratamento com CLA aumentou a liberação de ácidos graxos das células para o meio. Sendo que os isomeros c9t11 e t9t11 não afetaram aqueles parâmetros bioquímicos.
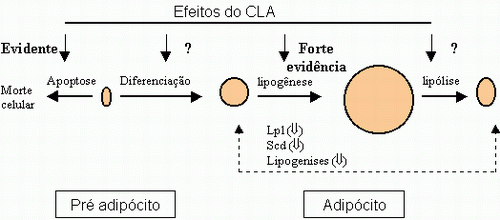
As alterações na composição corporal apresentadas na tabela 2 foram associadas ao fornecimento do isómero t10c12. Segundo Pariza (2001), as evidências deste e outros trabalhos são conclusivas dos efeitos do t10c12, sendo parte dos efeitos devido a redução da captação de lipídios pelo adipócito. Esta redução parece estar envolvida com os efeitos do CLA na atividade da esteraoil-CoA desaturase e da lipase lipoprotéica.
A ação do isómero t10c12 na esteraoil-CoA desaturase parece ser tanto na inibição na expressão como na atividade enzimática (CHOI et al, 2000). Segundo Pariza et al (2000) isto explicaria a diminuição na síntese de gordura no leite de vacas. O mecanismo de atuação na atividade da lipase lipoprotéica é desconhecido, mas fortes evidências indicam que a ação é direta do composto, ao invés de seus metabólitos (Pariza, 2001).
Tsuboyama-Kasaoka et al. (2000) e mais tarde Pariza (2001) relatam apoptose (morte programada) em células adiposas em ratos recebendo dietas com 1% de CLA. Pariza (2001) revisou que t10c12 também induziu a apoptose em culturas de células (3T3-L1) de ratos. Entretanto em outro trabalhou, foi observado que em ratos recebendo suplemento dietético com CLA apresentaram diminuição no tamanho das células e não no número. De modo geral Pariza (2001) relata que com base em trabalhos realizados por sua equipe é possível concluir que em ratos o CLA induz a apoptose nos pré-adipócitos.
A ação do CLA na diferenciação do pré-adipócito ainda não está bem definida. Alguma evidências segundo Pariza (2001) é de que dados de maior consistência indicam que o CLA (t10c12) bloqueia a diferenciação ao invés estimular.
Outro ponto de discussão é o efeito lipolítico do CLA, que ainda segundo o mesmo autor, ainda é um pouco obscuro, pois existem poucas evidências. Alguns trabalhos concluíram que o CLA bloqueia a deposição de “nova gordura” e não necessariamente reduz a gordura pré formada. Provavelmente a perda de tecido adiposo seria em função da lipolíse normal do organismo.
Recentemente Smedman e Vessby (2001) forneceram 4,2 g de CLA, com proporções iguais entre isomeros c9t11 e t10c12, a mulheres entre 23-63 anos de idade durante 12 semanas. Neste trabalho observou-se um diminuição em 3,7% de gordura corporal para o grupo que recebeu CLA, apesar destas mudanças não terem gerados diferenças significativas entra os grupos.
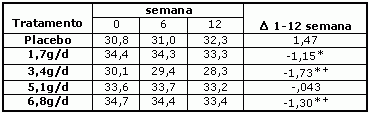
Blankson et al. (2000) em trabalho semelhante, porém com homens obesos, forneceu por 12 semanas níveis crescentes de CLA (1,7, 3,4, 5,1, 6,8g/d). Os autores relatam diferenças significantes na redução de gordura corporal do CLA em comparação ao placebo (Tabela 3). Porém, diferenças na composição do tecido magro não forma observadas, bem como em parâmetros bioquímicos do sangue. Os autores concluíram que a redução da gordura corporal foi atingida com 3,4 g/d de CLA. Com base em observações e em trabalhos realizados por Vessby et al. (2001) o CLA em dietas humanas provoca a redução da proporção de gordura corporal, especialmente abdominal.
Tabela 3: Efeito do CLA na massa de gordura corporal de homens e mulheres obesos.
*diferença entre CLA e placebo (P<0,05), +diferença entre as doses de CLA (P<0,05) Fig. 3: Modelo proposto para ação do trans 10 cis 12 no adipócito e pré-adipócito.
Autores como Krietchevsky (2001) relataram uma diminuição na ateroesclerose ao fornecer 0,1, 0,5 ou 1% de CLA a coelhos. Nos animais tratados observou-se maiores concentrações de lipídios circulantes, e maior concentração hepática de lipídios. Em outro trabalho relatado em hamsters, o CLA reduziu as concentrações de colesterol, VLDL, LDL e triglicerídeos, sem mudanças no HDL.
Pariza et al. (2001) estabeleceu que CLA (c9t11/t10c12) reduziu a secreção de apolipoproteína B em culturas de hepatomas humanos. Isto pode ter ocorrido pela ação inibitória do isómero t10c12 na expressão e atividade da esteroil desaturase. Outros trabalhos relatam aumento de fígado em várias espécies em função do acumulo de gordura.
Nos ensaios humanos de Smedman e Vessby (2001) e Blankson et al. (2000), não foram constatadas alterações nas concentrações séricas de triglicerídeos, LDL ou HDL.
Já Benito et al (2001), concluiu em seu trabalho que o CLA não parece oferecer benefícios a prevenção de ateroesclerose em humanos. Pois ao suplementar por dois meses 17 mulheres (normolipidemicas) saudáveis, não foram notados efeitos na concentração sérica de colesterol ou lipoproteínas. Os autores relatam ainda que o CLA dietético não foi incorporado ao tecido adiposo em níveis significantes, sugerindo que em humanos o CLA é metabolizado rapidamente em outros produtos.
Talvez para observação de alterações nas concentrações de lipoproteínas e colesterol em humanos, seja necessário a suplementação por um período mais longo. O período de suplementação no trabalho acima citado foi de apenas 9 semanas (período pré experimental + experimental), enquanto nos trabalhos com coelhos e hamsters foram de 11 a 13 semanas. Apesar de coelhos e hamsters serem usados como modelos animais, devemos considerar que são herbívoros, sendo que os efeitos observados nestas espécies, não necessariamente se aplicariam a seres humanos.
Willians (2000) discorre sobre a necessidades de estudos mais aprofundados em seres humanos, como dose e duração do tratamento. Também é necessário estudos epidemiológicos em diferentes populações para que se avalie a incidência de doenças e em relação ao tipo de dieta.
7 – Efeitos no músculo esquelético e sistema imune
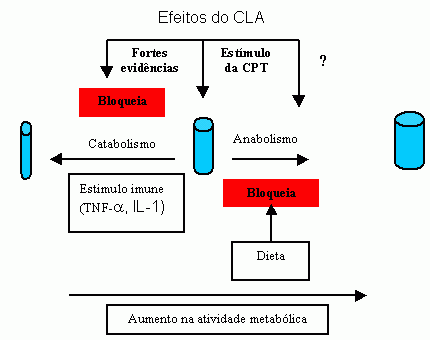
Os efeitos do CLA na musculatura esquelética ainda são pouco entendidos, em comparação com os efeitos no tecido adiposo. Os “possíveis efeitos” do CLA no tecido muscular são descritos na figura 4.
As evidências da ação do CLA no músculo são limitadas aos relatos de que a atividade da CPT seja estimulada em ratos (Park et al. 1999), o que estimularia a B-oxidação. Como discutido anteriormente, o fornecimento do CLA estimula efeitos no anabolismo protéico em ratos, porcos e possivelmente em humanos.
Pariza et al. (2001) indica que, com base nos trabalhos realizados por seu grupo, há fortes evidências de que ocorra uma associação entre efeitos fisiológicos, a proporção de tecido magro e o sistema imune, interligados por complexo sistema bioquímico. Algumas propostas indicam que o CLA preserva a massa muscular ou de que estimula as mudanças na regulação ou ação do fator alfa de necrose tumoral (TNF-alfa) e das interleukinas-1 (IL-1), citoquininas estas que afetam profundamente o catabolismo muscular assim como a massa muscular.
Durante a resposta imune, os macrófagos liberam as citoquininas e TNF-alfa e IL-1. Estas citoquininas iniciam o catabolismo protéico dos músculos. Estas substâncias estimulam a produção de prostaglandina no músculo. A prostaglandina (derivado do ácido linoléico) quando aplicada diretamente no músculo, iniciam o processo catabólico (Cook 1999).
Fig. 4: Modelo para possíveis efeitos do CLA no tecido muscular.
A forma com que a o CLA modula a resposta imune se dá através da sinalização de eicosanóides e outro mediadores lipídicos. O CLA pode afetar a síntese ou a mediação deste mediadores. O CLA na célula é desaturado e alongado, e então metabolizado produzindo vários eicosanoides derivados do CLA e outros novos mediadores. Eicosanóide é o ácido graxo com 20 carbonos, derivado do CLA e principalmente do ácido Aracdónico, que é precursor da prostaglandina (Pariza et al., 2000).
Todo célula de um organismo apresentam receptores para TNF-alfa, e várias células podem produzir está citoquinina. A ação e síntese do TNF-alfa e IL-1 é regulada pela ação de eicosanoides, em particular a prostaglandina.
Enquanto a prostaglandina regula a resposta imune, e em um primeiro momento estimulando esta resposta, em uma segunda fase pode inibir a ocorrência da mesma (dow-regulation). Desta forma o CLA inibe a produção de prostaglandina, principalmente em tecido não linfóide, impedindo a “dow-regulation” da resposta imune durante a reação imune (Cook, 1999).
A TNF-alfa é mediador em diversas patologias incluindo, caquexia, ateroesclerose e carcinogênese, utilizando vias de sinalização múltiplas, que assim como o CLA é multifuncional.
Ratos injetados com TNF-alfa e suplementados com CLA, apresentaram menor perda de peso, indicando efeito de proteção contra caquexia. Os autores concluíram que o CLA pode modular a resposta ao TNF-alfa, possivelmente pela regulação de eicosanoides derivados de CLA (Pariza et al., 2000). Os autores sugerem que esta ação do CLA na regulação da TNF-alfa possa explicar algumas de suas “multifunções”.
Lowery (2001) relatou recentemente que ao suplementar homens saudáveis por seis semanas com CLA, e submete-los a exercícios físicos (dowhill run), houve decréscimo das concentrações sérica de IL-6, e tendência em diminuir dor muscular por exercício físico 24 e 48h após a atividade.
Através destes efeitos nas citoquininas, Decker (1999) revisou que o CLA pode atuar na formação óssea. Dietas ricas em gorduras contendo CLA, quando comparadas com outras ricas em óleo de soja, causaram uma maior taxa de formação óssea.
8 – Efeitos anti-carcinogénico
Após a identificação inicial do poder modulador da mutagênese e carcinogênese do CLA, o interesse em pesquisas aumentaram. Em experimentos in vitro os isomeros de CLA apresentam efeitos antioxidantes, e nas células protegem as membranas de ataques oxidativos. Apesar de serem menos efetivos que o beta-caroteno, são mais efetivos que o alfa-tocopherol. Muitas das substâncias antimutagênicas e antioxidantes são anticancerigenas (Steinhart, 2001).
A atividade biológica do CLA foi descoberta pelo seu efeito inibitório na carcinogênese quimicamente induzida em ratos, sendo os efeitos confirmados em novos estudos tanto in vitro, como em modelos animais.
Apesar dos vários trabalhos, o mecanismo de como o CLA inibe a carcinogênese ainda não é conhecido, mas acredita-se que pode envolver efeitos no metabolismo do ácido linoléico e da vitamina A. Pariza (2001) relata que os efeitos dos isomeros nas células cancerígenas são complementares, tendo fortes evidências de que o c9t11 e t10c12 apresentam interações sinérgicas em inibir o câncer.
Recentemente Wahle et al. (2001) sugere que o CLA atua em câncer de próstata e mama por modular a apoptose. Outros trabalhos sugerem que os efeitos estariam associados a respostas imunológicas com diminuição de TNF-alfa (Pariza et al., 2000) e prostaglandina (Miller et al., 2001).
A ação anti-carcinogênica dos isomeros do CLA, parecem ter efeitos complementares. O isomero cis-9 trans-11 mostrou reduzir efetivamente a neoplasia mamaria em ratos. Ip et al (1994) descreve que o CLA preveniu o câncer na glândula mamaria de ratas, quando fornecidos cronicamente nas dietas antes da administração do carcinógeno. Neste trabalho, doses entre 0,05 e 0,5% de CLA na dieta foram o suficiente para produzir tais efeitos. Os autores especulam que mudanças no desenvolvimento da glândula e na morfogênese podem ser os pontos de ação do CLA na modulação da carcinogenese na glândula mamaria. Anteriormente Schultz et al (1992) já havia relatado efeitos citotóxicos do CLA e do beta-caroteno em células cancerígenas humanas.
Deker (1999) relata que inúmeros trabalhos com outros tipos de câncer, como melanoma, colon-retal, pulmão, próstata, leucemia, ovário e fígado vem sendo realizados, demonstrando potente efeito anticarcinogênico do CLA.
Os estudos demonstram que a dieta é uma importante rota para proteção contra o câncer. Segundo Bauman e Kelly (1997), estima-se que o consumo de CLA seja de apenas um terço das quantidades necessárias para se obter efeitos de proteção contra o câncer nos tecido. Os autores relatam ainda que são poucos os estudos epidemiológicos examinando o CLA na dieta e o risco de câncer, bem como a dose diária recomendada. Entretanto, autores como Willians (2000) sugerem que a ingestão de CLA na dieta deva ser estimulada, bem como técnicas para aumentar a concentração deste na carne e leite.
9 – Outros efeitos do CLA
Os estudos com CLA tem mostrado a existência de outros efeitos deste composto, tais como a melhora na eficiência alimentar e no crescimento em ratos. Pariza (2001) relata que filhotes de ratas que receberam CLA durante a lactação, foram mais pesados, e na desmama tivera melhor conversão alimentar em relação ao controle.
O CLA também tem mostrado efeitos em normalizar ou reduzir a glicose sanguínea, e possivelmente prevenir a diabetes. Ensaios em laboratórios com animais utilizados como modelos para diabetes, o CLA preveniu o desencadeamento da diabetes. Porém segundo Deker (1999) estes resultados ainda não são suficientes para realizar proposições a este respeito, sendo necessário mais trabalhos na área.
10 – Dose terapêutica e consumo diário de CLA
Os trabalhos com CLA na sua maioria foram realizados com animais, sendo que em humanos ainda são poucos os trabalhos. De acordo com Willians (2000) os efeitos do CLA são bastante evidentes naqueles modelos, porém a maior dificuldade seria extrapolar as doses efetivas para humanos. O autor sugere que mais trabalhos com humanos, e diferentes doses devem ser realizados, bem como estudos epidemiológicos na incidência de doenças e o tipo de dieta que a população é exposta.
Deker (1999) observou que em alguns estudos epidemiológicos existe a confirmam de que há algum fator no leite que exerce efeitos de proteção contra câncer de mama e doenças cardíacas. Sendo que a menor incidência destes efeitos foram notadas com consumo do leite integral, e não com leite desengordurado. Especula-se que tais efeitos sejam pelo CLA encontrado na gordura do Leite.
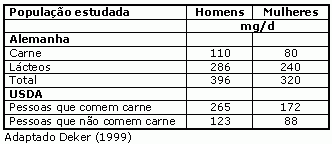
O consumo de CLA disponível em dados de consumo do USDA CSFII 94-96 (Continuing Survey of Food Intake of Individuals), indica que aproximadamente 36% do CLA total é oriundo da ingestão de carne, e aproximadamente 52% de produtos lácteos. Na tabela 4 são apresentados resultados dos dados do USDA e da Alemanha quando ao consumo diário de CLA.
Tabela 4: Consumo estimado de CLA em humanos
11 – Conclusões
Os isomeros de Acido Linoléico Conjugado apresentam inúmeros efeitos biológicos já reconhecido em animais quanto a prevenção de diversos tipos de câncer, e modulação do metabolismo do tecido adiposo, tecido muscular e potente estimulador do sistema imune. Pesquisas vem sendo realizadas de modo a entender as reações bioquímicas, bem como a atuação de cada isomero.
Em relação a sua ação em seres humanos existem poucos resultados conclusivos, sendo a grande maioria inferências de estudos in vitro e com animais. Desta forma pesquisas em seres humanos, bem como estudos epidemiológicos ainda devem ser realizados para que se possa comprovar a ocorrência de tais efeitos, doses terapêuticas e preventivas.
Entretanto, atualmente o CLA pode ser considerado apenas uma “gordura” potencialmente benéfica a saúde.
12 – Referencias Bibliográficas
Bauman, D. E.; Kelly, M. Conjugated linoleic acid: a potent anticarcinogen founf in milk fat. In: 2º Annual Protiva Science Symposion, 1997.
Benito, P.; Nelson, G. J.; Kelly, D. S.; Bartiolini, G.; Schidt, P.C.; Simon, V. The effect of conjugated linoleis acid on plasma lipoproteins and tissue fatty acid composition in humans. Lipids, 36(3), 2001.
Blankson, H.; Stakkestad, A.; Fagertun, H.; Thom, E.; Wadstein, J. Conjugated linoleic acid reduces body fat mass in overweight and obese humans. Journal of Nutrition, 130: 2943-2948, 2000.
Choi, Y. J.; Kim, Y. C.; Han, Y. B.; Pariza, M. W.; Ntambi, J. M. The trans-10 cis12 isomer of conjugated linoleic acid downregulates steroyl_CoA desaturase 1 gene expression in 3t3-L1 aipocytes. J. Nutr. 130:1920-1924. 2000.
Choinard, P. Y; Bauman, D. E., Baumgard, C.; Baumgard, L. H.; McGuire, M. A.; Giesy, J. G. An update on conjugated linoleic acid. In: Proccedings of the 1999 Cornell Nutrition Conference for feed manufactors. 61th Meeting. P.93-101, 1999.
CooK, M. E. Conjugated linoleic acid. An update on conjugated linoleic acid. In: Proccedings of the 1999 Cornell Nutrition Conference for feed manufactors. 61th Meeting. p. 102-108, 1999.
Cook, M. E.; Jerome, D. L.; Crenshaw, D. R., et al. Feeding conjugated linoleic acid improves feed eficiency and reduces carcass fat in pigs. FASEB abstract. 1998.
Decker, E. A. Conjugated linoleic acid and dietary beef-Na update. Beef Facts: www.beefnutrition.org, 1999.
Dhiman, T. R.; Olson, K. C.; MacQueen, I. S.; Pariza, M. W. Conjugated Linolei Acid content of meat from steers fed soybean oil. Journal of Dairy Science, 82 (Suppl. 1): 84 (Abstr.). 1999.
French, P.; Stanton, C.; Lawless, F.; Riordan, E.G.O.; Monahan, F.J.; Cafffrey. P.J.; Moloney, A.P. Fatty acid composition, including conjugated linoleic acid, of intramuscular fat from steers offered grazed grass, grass silage, or concentrate-based diets. J. Anim. Sci. , v. 78, p. 2849-2855, 2000.
Ip, C.; Thompson, H. J.; Scimeca, J. A. Conjugated linoleic acid suppresses mamary carcinogenesis and proliferative activity of the mammary gland in the rat. Cancer Research, 54:5, 1212-1215. 1994.
Kritchevsky, D.; Effcts of CLA in experimental atherosclerosis. In: Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. p. 27. 2001.
Lock, A. L.; Garnsworthy, P. C. The effects of fresh conserved grass diets on the conjugated linoleic acid content of cow´s milk. Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. 2001.
Lowery, L. Effects of conjugated linoleic acid on physiologic consequences of downhill run. Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. p. 45. 2001.
Medeiros, S. R.; Oliveira, D. E.; Aroeira, L. J. M.; McGuire, M.; Lanna, D. P. D. Supplementation of lactating cows grazing stargrass *Cynodon nlenfuensis var, nlenfuensis) with conjugated linoleic acid: effects on persistency and estimated net energy balance. Proceedings of The XIX International Grassland Congress. p.707. 2001.
Miller, A., McGrath, E.; Devery, R.; Stanton, C. Effects of vaccenic and CLA on growth of human colon cancer cells. In: Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. p. 46. 2001.
Pariza, M. W.; Park, Y.; Cook, M. E. The biologically active isomers of conjugates linoleic acid. Progreess in lipid research. 40, 283-298. 2001.
Pariza, M. W.; Park, Y.; Cook, M. Mechanisms of action of conjugated linoleic acid: Evidence and especulation. P.S.E.B.M., v. 223, 2000.
Park, Y.; Albright, K. L.; Storkson, J. M.; Liu, W.; Pariza, M. W.; Evidence that conjugated linoleic acid induces body composition changes in mice. Lipids, 34:235:241. 1999.
Stene, O.; Thuen, E.; Haug, A.; Lindstad, P. Conjugated linoleic acid (CLA) in milk from cows of two different production systems. In: Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. p. 46. 2001.
Shultz, T. D.; Chew, B. P.; Seaman, W. R.; Luedecke, L. O. Inhibitory effect of conjugated dienoic derivates of linoleic acid and beta carotene on the in vitro growth of human cancer cells. Cancer Lett, 63(2), 125-133.
Steinhart, C. Conjugated linoleic acid: The good news about animal fat. Journal of Chemistry Education, 73, 1996.
Tsuboyama-Kasaoka, N; Takahashi M.; Tanemura, K; et al. Biabetes, 2000;49:1534: 42.
Vessby, B.; Risérus, U.; Smdman, A.; Basu, S. Metabolic effects of conjugated linolei acid (CLA) in humans. Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. p. 18. 2001.
Wahle, K. W. J.; Heys, S. D.; Majumder, B. Barker, P.; Song, H. J. Sneddon, A.; Bestwick, C.; McClinton, S.; Grant, I. Conjugated linoleic acids modulate apoptotic and anti-cancer signal mechanisms in breast and prostate cells. In: Proceedings of The 1th International Conference on Conjugated Linoleic Acid (CLA). Alesund, Norway. p. 11. 2001.
Willians, C. M. Dietary fatty acids and humans health. Ann. Zootech, 49: 165-180, 2000.
Yang, X.; Isolation, identification and characterization of conjugated linoleic acid-producing Lactobacillus reuteri PYR8. Phd. Thesis, University of Wisconsin-Madison, 1997.


