Ruim para quem vende, bom para quem compra
30 de janeiro de 2004Síntese Agropecuária BM&F – 31/01/04
31 de janeiro de 2004Colágeno e qualidade da carne
Por Angélica Simone Cravo Pereira1 e Albino Luchiari Filho2
A textura da carne é um dos fatores mais importantes na determinação da qualidade da carne sob o ponto de vista dos consumidores mais exigentes. O tecido conjuntivo intramuscular atua como parte significante na determinação da textura da carne e a estabilidade mecânica aumenta progressivamente com o crescimento do animal. No tecido conjuntivo típico, os elementos de maior importância para a ciência da carne, são a presença de colágeno, do tropocolágeno e da elastina, responsáveis pela variação da maciez da carne (Luchiari, 2000). De acordo com o mesmo autor, o colágeno é a proteína presente em maior quantidade no organismo animal e o elemento mais fibroso do tecido conjuntivo. As fibras de colágeno podem ser encontradas na pele, ossos, tendões e paredes arteriais, assim como no epimísio, perimísio e endomísio dos tecidos musculares dos mamíferos. A variação na maciez da carne tem sido estudada por diversos pesquisadores, entre diversos músculos presentes na carcaça (Shackelford et al., 1995; Rhee et al., 2003) (Figura 01).
A distribuição do colágeno está relacionada também com a atividade física e localização no músculo: nas extremidades a quantidade de colágeno é maior, sendo a carne menos macia. Além disso, o m. Psoas major (filet mignon) e o Infraspinatus são considerados mais macios e o Biceps femoris (Picanha), Semitendinosus (Lagarto), Supraspinatus (Peixinho), Adductor, e Semimembranosus (Coxão Mole) são menos macios que outros músculos.
A fonte de variação na maciez desses músculos é devido, dentre outros fatores, ao comprimento do sarcômero, conteúdo de colágeno presente, extensão da proteólise pós-morte da cadeia das proteínas miofibrilares e interação desses fatores na maciez de cada músculo (Wheeler et al., 2000; Rhee et al., 2002). Ainda, o comprimento do sarcômero, conteúdo de colágeno presente nos músculos, e o processo de proteólise poderiam ser explicados na maciez da carne maturada. Entretanto, a relativa contribuição de cada um dos componentes, que leva à maciez da carne é músculo dependente.
O músculo mais macio, Psoas major, é assim considerado, devido à combinação de um maior comprimento de sarcômero e reduzida quantidade de colágeno presente, além de pouca atividade de proteólise. Por outro lado, o m. Infraspinatus é considerado macio, devido ao comprimento do sarcômero, que é relativamente maior, juntamente com elevado conteúdo de colágeno presente, além de possuir baixa atividade proteolítica. Além disso, os músculos Biceps femoris, Supraspinatus, e Semitendinosus podem ser considerados, mais macios e com elevado conteúdo de colágeno.
Porém, o m. Biceps femoris é considerado o de maior atividade proteolítica pós-morte, além de possuir menor comprimento de sarcômero, enquanto o Semitendinosus possui maior comprimento (> 2.0 µm) e quantidade intermediária de atividade das proteólises. O m. Supraspinatus é considerado baixo em capacidade de proteólise e comprimento intermediário de sarcômero (Figura 02). Portanto, diferentes músculos poderiam obter níveis similares de maciez, que resultariam de amplas e diferentes combinações de maiores comprimentos de sarcômero, proteólise pós-morte e conteúdo de colágeno. Entretanto, a utilização de algumas estratégias para a melhora da maciez da carne (ver artigo Efeito de Algumas Técnicas Pós-Morte a fim de Melhorar a Qualidade da Carne 16/06/2003) poderia minimizar essas diferenças entre músculos.
De acordo com Nishimura et al. (1999), mudanças estruturais no tecido conjuntivo intramuscular do m. Longissimus, no início do período de engorda de bovinos são similares àquelas do m. Semitendinosus. Essas mudanças a respeito da resistência do tecido conjuntivo podem contribuir para o aumento da dureza no m. Longissimus de animais com idade até 20 meses e 32 meses para o m. Semitendinosus.
Além disso, Nishimura et al. (1999), afirmaram, que a resistência mecânica do m. Semitendinosus aumentou à medida que aumentou também o período de engorda em que bovinos foram submetidos. Porém, o conteúdo de colágeno total no músculo não aumentou. Por outro lado, no m. Longissimus a resistência mecânica do músculo cru e cozido aumentou, no início período de engorda de animais com idade superior a 20 meses, entretanto, o conteúdo de colágeno diminuiu neste período. Isso poderia sugerir, que alterações na quantidade de colágeno total, relacionada à idade do animal, não contribuem diretamente para a maciez da carne. Todavia, a diminuição da quantidade de colágeno no músculo em animais, após 20 meses de idade, poderia influenciar a maciez desses músculos.
Grande parte da variação na maciez da carne é atribuída à atividade das proteases cálcio dependentes no músculo pós-morte. Porém, a taxa de aumento da dureza da carne também está relacionada com o aumento da resistência do colágeno (Field et al., 1996). Mc Cormick (1994) observou uma relação ampla existente do colágeno durante o processo de maturação da carne. Ainda, a forma de manejo pode alterar o crescimento, acréscimo muscular, e as características do colágeno em animais. Aumentando, ou reduzindo o plano de nutrição, ganho compensatório, testosterona e somatotropina mediados no crescimento, além de exercício podem ainda modificar a ligação e/ ou tipo de colágeno proporcionalmente. Conseqüentemente, há um aumento na força de cisalhamento desses músculos, resultando em menor maciez da carne cozida.
Porém, recentes estudos têm investigado a função do tecido conjuntivo na maciez da carne. Alguns autores observaram, que componentes específicos do tecido conjuntivo, incluindo a função do perimísio (septos, que recobrem pequenos feixes de fibras) na maciez da carne. O tecido conjuntivo é distribuído através do sistema esquelético do músculo e atua a fim de manter a integridade do sistema, ou de cada músculo, completando a função, como um sistema locomotor ativo. Embora, o mesmo seja composto de colágeno, elastina, proteoglicanas e proteínas estruturais (fibronectina, laminina, etc) a fibra do colágeno é um importante fator para o desenvolvimento da maciez da carne (Nakamura et al., 2003).
Além disso, grau de contração do colágeno intramuscular bovino decresce a 7, 8oC 7 dias pós-morte. Ainda, a tensão isométrica do colágeno intramuscular diminui 21 dias pós-morte em carne bovina (Nishimura et al., 1995). Esses resultados sugeriram, que há muitas alterações no tecido conjuntivo intramuscular no processo pós-morte. Os tipos I, III, IV, V e VI de colágeno são detectados no músculo esquelético, em que os maiores componentes do colágeno são do tipo I, seguidos pelo tipo III (Nakamura et al., 2003). Além disso, as fibras de colágeno apresentam diferentes arquiteturas entre o perimísio e endomísio, dos quais são formados principalmente de feixes espessos de colágeno, entretanto os últimos citados mostram uma rede fina e delgada de pequenos feixes (Nakamura et al., 2003).
A quantidade de colágeno intramuscular varia entre os músculos, como descrito anteriormente. Ainda, o volume, a química e a arquitetura da quantidade de colágeno são alterados com o aumento da dureza da carne, com o avanço da idade (Nakamura et al., 2003). A existência de pontes intermoleculares torna as fibras de colágeno com maior estabilidade em maior número e inextensibilidade. Entretanto, à medida que o animal envelhece essas ligações tornam-se mais estáveis, insolúveis, portanto dificilmente seriam rompidas, resultando em menor maciez da carne. Segundo Nakamura et al. (2003), o tecido adiposo ocupa o espaço interior do perimísio, como um grupo de grandes células globais (150-200mm de diâmetro). Outros autores sugeriram, que a deposição de gordura no tecido fez a carne ficar mais macia, pela quebra dos feixes de colágeno duro no perimísio do m. Longissimus de bovinos.
Posteriormente, Brooks e Savell (2004), observaram diferenças na gordura do perimísio de músculos de bovinos. Além disso, houve uma correlação entre a força de cisalhamento (maciez) dos músculos e a gordura do perimísio, quando as carcaças foram submetidas à estimulação elétrica. Houve uma significante correlação entre a gordura do perimísio e a força de cisalhamento dos músculos. Isso poderia estar relacionado com o processo de cozimento dos componentes da carne, tais como, tecido conjuntivo e miofibrilas. Esses resultados indicaram ainda, que a presença de gordura do perimísio tem melhor impacto na maciez em períodos de maturação superiores há 14 dias pós-morte. Outros autores observaram uma redução da força de cisalhamento, atribuída a degradação do perimísio e à degradação miofibrilar.
Contrariamente, Wipple et al. (1990) não observaram correlação entre a presença de colágeno solúvel e total na maciez da carne maturada 14 dias pós-morte. Palka, (2003) observou um aumento na quantidade de colágeno solúvel em bifes assados a 80oC. Em contrapartida, houve menores perdas no cozimento em carnes maturadas por 12 dias e a seguir assadas, em relação àquelas maturadas apenas por 5 dias e submetidas ao mesmo procedimento (Figura 03).
Conclusões
Músculos podem ter similar maciez, devido diferentes razões.
A fim de explicar melhor a função do colágeno e sua influência nos processos de maciez da carne, são necessárias ainda muitas pesquisas nesta área, visando atender à demanda de um consumidor cada vez mais exigente por carne mais macia com qualidade diferenciada.
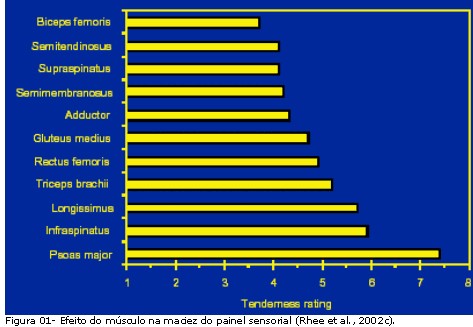
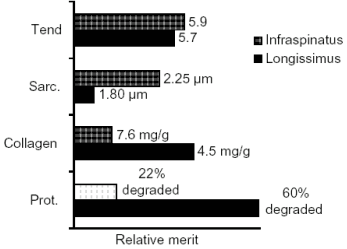
Figura 02- Contribuição do comprimento do sarcômero, conteúdo de colágeno,e proteólise pós-morte, para a maciez de dois músculos. Adaptado de Rhee et al. (2002).
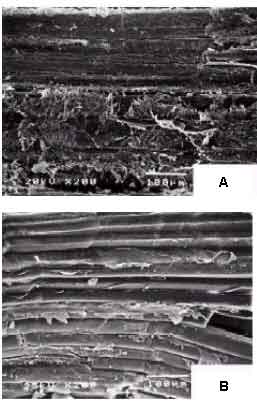
Figura 03 – Microestrutura do perimísio e endomísio do m. Semitendinosus com 5 dias de maturação e temperatura interna 80oC (A) e 12 dias de maturação com temperatura interna 80ºC (B) x (200) Palka, (2003).
Referências bibliográficas
BROOKS, J.C.; SAVELL, J.W. Perimysium thickness as an indicator of beef tenderness. Meat Sci., v.67, p.329-334, 2004.
FIELD, R.; MCCORMICK, R.; BALASUBRAMANIAN, V.; SANSON, D.; HIXON, J. D.; RILEY, M.; RUSSELL, W. Growth, Carcass, and Tenderness Characteristics of Virgin, Spayed, and Single-Calf Heifers. J. Anim. Sci. v.74, p.2178-2186, 1996.
LUCHIARI FILHO, A. Pecuária da Carne Bovina. São Paulo, 2000.
MCCORMICK, R. J. The flexibility of the collagen compartment of muscle. Meat Sci. v.36, p.79-91, 1994.
NAKAMURA, Y.N.; IWAMOTO, H.; ONO, Y. SHIBA, N.; NISHIMURA, S.; TABATA, S. Relationship among collagen amount, distribution and architecture in the M. longissimus thoracis and profundus from pigs. Meat Sci. v.64, p.43-50, 2003.
NISHIMURA, T.; HATTORI, A.; TAKAHASHI, K. Structural Changes in Intramuscular Connective Tissue During the Fattening of Japanese Black Cattle: Effect of Marbling on beef Tenderization. Meat. Sci. v.77, p.93-104, 1999.
NISHIMURA, T.; HATTORI, A.; TAKAHASHI, K. Structural Weakening of Intramuscular Connective Tissue during Conditioning of Beef. Meat Sci. v.39, p.127-133, 1995.
PALKA, K. The influence of postmortem ageing and roasting on the microstructure, texture and collagen solubility of bovine semitendinosus muscle. Meat Sci. v.64, p.191-198, 2003.
RHEE, M. S.;. WHEELER, T. L.; SHACKELFORD, S. D.; KOOHMARAIE, M. Variation in palatability and biochemical traits within and among major beef muscles. Proc,. Recip. Meat Conf. v.55, p.146, 2002.
SHACKELFORD, S. D.; WHEELER, T. L.; KOOHMARAIE, M. Relationship between shear force and trained sensory panel tenderness ratings of 10 major muscles from Bos indicus and Bos taurus cattle. J. Anim. Sci.. v.73, p.3333-3340, 1995.
WHEELER, T. L.; SHACKELFORD, S. D.;KOOHMARAIE, M.. Variation in proteolysis, sarcomere length, collagen content, and tenderness among major pork muscles. J. Anim.Sci. v.78, p.958-965, 2000.
WHIPPLE, G.; KOOHMARAIE, M.; DIKEMAN, M.E.; CROUSE, J.D. Predicting beef-longissimus tenderness from various biochemical and histological muscle traits. J.Anim. Sci. v.68, p.4193-4199, 1990.
______________________________________________________________
1Angélica Simone Cravo Pereira é pós-graduanda em Qualidade e Produtividade Animal, FZEA – USP, Pirassununga.
2Albino Luchiari Filho é Zootecnista, Diretor e consultor LinBife e Prof. da Faculdade de Zootecnia e Engenharia de Alimentos sa USP – Pirassununga


