6º Leilão Caracu Top Brasil
7 de julho de 2005In natura: Brasil exporta 115 mil toneladas em junho
7 de julho de 2005Inseminação em tempo pré-fixado: o que interfere nos resultados
A inseminação artificial em tempo fixo (IATF) é uma técnica que visa facilitar o manejo da inseminação artificial, reduzindo a mão-de-obra (observação de cio) e concentrando as atividades. Como qualquer outra técnica não pode ser aplicada em todas as condições de manejo existentes e merece detalhada avaliação do seu custo benefício, pois os resultados dos trabalhos de pesquisa ainda apontam, além de um custo de medicamentos muito elevado, taxa de gestação inferior ao protocolo padrão da inseminação.
Estes protocolos de IATF atualmente possuem muitas variações, porém se baseiam nos seguintes eventos básicos: Sincronização da onda de desenvolvimento folicular, Indução da Luteólise e Indução da ovulação. Estes três processos são promovidos pela aplicação de hormônios e devem ocorrer em períodos pré-determinados.
São mecanismos utilizados numa seqüência, cuja eficiência de cada passo depende, além do sucesso no passo anterior, da existência de condições para atuação de cada um dos produtos aplicados. Para qualquer hormônio exercer seu efeito, é preciso que ele “se encaixe” na célula onde ele vai atuar num local conhecido como “receptor”. Portanto, para que a ação do hormônio ocorra, é necessário que existam receptores nas células onde ele vai atuar. A existência, assim como a quantidade de receptores é o que vai condicionar a eficiência da terapia hormonal.
O passo inicial para os protocolos de IATF é a sincronização da onda de desenvolvimento folicular. Para que esta etapa ocorra de forma satisfatória, é imprescindível que a fêmea já possua este tipo de padrão de desenvolvimento folicular. Além disto, para que ocorra a emergência de uma nova onda (objetivo desta etapa) é importante que no momento da aplicação do produto com esta finalidade existam folículos com receptores suficientes para responder a esta terapia. Não é em todos os dias do ciclo que existem estes folículos. Vários trabalhos demonstram que para responder com atresia, ovulação ou sofrer luteinização parcial, o folículo deve possuir condições mínimas, ou seja, possuir receptores para hormônios específicos.
Estes receptores somente existem nos folículos a partir de um certo desenvolvimento. Desta forma, no início das ondas de desenvolvimento folicular, não existem folículos que respondem aos produtos aplicados, não havendo sincronização da nova onda de desenvolvimento folicular e comprometendo todo o processo.
Figura 1: Em alguns dias do ciclo estral podem não existir folículos que respondam a sincronização da onda de desenvolvimento folicular
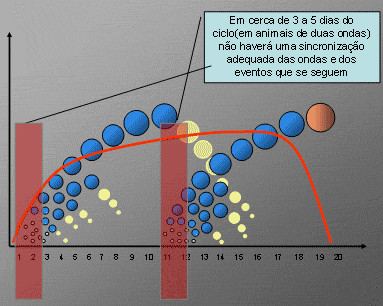
As principais variáveis que condicionam o sucesso da sincronização da onda de desenvolvimento folicular são o “status” folicular ovariano no momento da aplicação. Este aspecto está relacionado à presença e a sensibilidade (receptores) do folículo dominante ao LH endógeno. Desta forma, alguns animais não terão a emergência de uma nova onda e com isto o tamanho dos folículos no momento da indução de luteólise e posteriormente a ovulação pode não ser adequado, comprometendo todo o processo.
A segunda possibilidade de falha técnica esta na Indução da Luteólise. É um processo imprescindível, pois sem a queda da progesterona o final do desenvolvimento folicular e o processo de ovulação estariam comprometidos, além dos eventos relacionados, como transporte e capacitação de gametas e outros. Mais uma vez é importante ressaltar que também a prostaglandina (PGF) age em receptores localizados no corpo lúteo. Sabe-se que a presença de receptores para este hormônio na estrutura luteal aumenta com o passar dos dias após a formação do corpo lúteo. A literatura cita que o corpo lúteo apresenta sensibilidade a PGF a partir de 6-7 dias após a ovulação.
Assim sendo, caso a etapa anterior (sincronização da onda de desenvolvimento folicular) origine um corpo lúteo, pela indução da ovulação e/ou luteinização de um grande folículo presente neste momento, a aplicação de PGF 8 dias mais tarde pode não encontrar uma estrutura luteal com a quantidade de receptores suficientes para uma boa eficiência. Vale lembrar que após a aplicação do produto para sincronização da onda de desenvolvimento folicular, caso este induza a formação de um corpo lúteo, isto vai ocorrer cerca de dois dias mais tarde. Neste caso a PGF normalmente deverá ser suficiente para provocar lise de uma estrutura luteal com apenas seis dias de formada. Um grande desafio, pois os receptores neste período são em pequeno número.
Redução na dose de prostaglandina neste período, além da utilização de protocolos que aproximam a aplicação da PGF da droga que induz a sincronização das ondas é um erro e pode ser uma das grandes fontes de redução da eficiência.
A etapa final, a indução da ovulação, é a menos sujeita a problemas dentro do protocolo. Isto desde que as etapas anteriores tenham ocorrido de forma eficiente. Sem a sincronização da onda de desenvolvimento e redução nos níveis circulantes de progesterona, este processo final estará totalmente comprometido.
Se tudo tiver corrido bem anteriormente, a exigência em relação a potência biológica do produto é menor, pois existirá um folículo de grande diâmetro, altamente sensível ao LH. Sendo assim, quantidades adequadas de LH, poderiam ser induzidas por quantidades menores de análogos do GnRH, e seriam suficientes para provocar a ovulação.
Uma possível fonte de erro que poderia comprometer os resultados seria a indução da ovulação num período anterior ao desenvolvimento final do folículo. Caso isto ocorra, o folículo pode não ovular, ou mesmo que este processo ocorra, o oócito liberado não possuir as condições ideais para ser fecundado e formar o embrião. A relação temporal entre a indução da luteólise e da ovulação devem ser obedecidas com rigor pelas pessoas responsáveis pela aplicação dos produtos.
Considerações finais
Como discutido, o sucesso dos protocolos de IATF depende de uma série de fatores relacionados com atividade hormonal. A eficiência de cada etapa está diretamente relacionada com o sucesso da anterior. Como não existe nenhuma terapia hormonal 100% eficiente, no somatório dos três processos básicos, provavelmente, independente do tipo de protocolo e da seleção dos animais, haverá uma menor eficiência em relação aos eventos que ocorrem fisiologicamente. Seria muita pretensão admitir que com algumas aplicações de hormônios exógenos, poderíamos mimetizar exatamente, com a mesma eficiência, as complexas inter-relações hormonais existentes durante o desenvolvimento folicular e ovulação.
Isto, porém não deve desencorajar o uso da tecnologia de IATF. Importante é admitir que falhas podem e vão ocorrer, procurar limitá-las dentro das possibilidades e elaborar, sabendo desta menor eficiência relativa, a relação custo-benefício da adoção desta técnica.
Bibliografia consultada
ADAMS, G.P. Control of ovarian follicular wave dynamics in cattle: implications for synchronization and superstimulation Theriogenology. v.41, p.19-24, 1994.
BARTOLOME J.A., SILVESTRE F.T., ARTECHE A.C.M., KAMIMURA S. et al. The use of ovsynch and heatsynch for re-synchronization of crows open at pregnancy diagnosis by ultrasonography. Journal of Dairy Science, v.85, p.99, 2002 (abstract).
BIGELOW, K.L.; FORTUNE, J.E. Characteristics of prolonged dominant versus control follicles: follicle cell numbers, steroidogenic capabilities and messenger ribonucleic acid for steroidogenic enzymes. Biology of Reproduction. v. 58, p.1241-1249. 1998.
BÓ, G.A. Dinâmica folicular ovárica em el bovino. São Paulo – SP, 2000 In: Simpósio de Controle Farmacológico do Ciclo Estral em Ruminantes. Anais… Departamento de Reprodução Animal FMVZ-USP, p.11-34, 2000.
BUTLER W.R. Nutritional interactions with reproductive performance in dairy cattle. Animal Reproduction Science, v.60-61, p.449-457, 2000.
CARTMLL, J.A.; EL-ZARKOUNY, S.Z.; HENSLEY, B.A.; LAMB, G.C.; STEVENSON, J.S. Stage of cycle, incidence, and timing of ovulation, and pregnancy rates in dairy cattle after three timed breeding protocols. Journal Dairy Science, v.84, p.1051-1059, 2001.
CHENAULT, J.R. Effect of Fertirelin acetate or Buserelin on conception rate at first or second insemination in lacting dairy cows. Journal of Dairy Science, v.73, 633-638, 1990.
CHENAULT, J.R., KRATZERT, D.D., RZEPKOWSKI, R.A., GOODWIN, M.C. LH and FSH response of Holstein heifers to fertirelin acetate, gonadorelin and buserelin. Theriogenology, v.34, p.81, 1990.
COSTA, D.S. Sincronização da onda folicular com buserelina prévia a indução de luteólise com cloprostenol em bovinos. Univ. Federal de Viçosa, Dpto de Zootecnia. UFV – Viçosa, 1997, 110p. (disertação-Mestrado)
FERNANDES, C.A.C. Imunoneutralização Ativa da Inibina, Alterações na Fisiologia Reprodutiva e Resultados de Superovulação em Novilhas. Faculdade de Méd. Vet. E Zootec. Unesp_Botucatu. 2000, 142p.
FORTUNE, J.E. Ovarian follicular growth and development in mammals. Biology of Reproduction. v.50, p.225-232, 1994.
LANE, E.A.; AUSTIN, E.J.; ROCHE, J.F.; CROWE, M.A. The effect of estradiol benzoate or a synthetic gonadotropin-releasing hormone used at the start of a progesterone treatment on estrus response in cattle. Theriogenology, v.56, p.79-90, 2001.
LOPEZ-GATIUS, F,; LOPÉZ-BÉJAR, M. Reproductive performance of dairy cows with ovarian cysts after different GnRH and cloprostenol treatments. Theriogenology, v.58, p.1337-1348, 2002.
MAPLETOF, R.J.; BO, G.A.; ADAMS, G.P. Avanços na manipulação do ciclo estral de doadoras e receptoras nos programas de transferência de embriões em bovinos. Arquivos da Faculdade de Medicina Veterinária da UFRGS, v.28, n.1, p.24-51, 2000 (Supl.).
MOREIRA, F., De La SOTA, R.L.; DIAZ, T.; THATCHER, W.W. Effect od day of the estrous cycle at the initiation of a timed artificial insemination protocol on reproductive responses in dairy heifers. Journal of Animal Science, v.78, p.1568-1576, 2000.
PIERSON, R.A., GINTHER, J.0. Folicular populations during the estrous cycle in heifers. II – Influence ol right and left sides and intraovarian effect of the corpus luteum. Animal Reproduction Science, v.14, p.177-186, 1987.
RETTMER, I.; STEVENSON, S.; CORAH, R.L. Prenancy rates in beef cattle after administering a GnRH agonist 11 to 14 days after insemination. Journal of Animal Science, v.70, p.7-12, 1992.
TEFERA, M.; CHAFFAUX, S.; THIBIER, M.; HUMBLOT, P. A short note: Lack of effect of post Ai hCG or GnRH treatment on embryonic mortality is dairy cattle. Livestock Production Science, v.71, p.277-281, 2001.
WOLFENSON, D.; THATCHER, W.W.; SAVIO, J.D.; BADINGA, L.; LUCY, M.C. The effect of a GnRH analogue on the dynamics of follicular development and synchronization of estrus in lactating dairy cows. Theriogenology, v.42, p.633-644, 1994.


