EUA e UE lançam disputas comerciais na OMC
27 de janeiro de 2005Análise Semanal – 27/01/2005
27 de janeiro de 2005Leptina: uma alternativa do futuro
Por Angélica Simone Cravo Pereira1
A obesidade está relacionada como uma das maiores doenças do século, que atinge a população humana. Nos Estados Unidos, estima-se que 30% da população está acima do peso e cerca de 40% dos brasileiros encontram-se com peso acima do normal (ainda que esses dados tenham gerado muitas dúvidas, recentemente).
Muitas tentativas vêm sendo testadas a fim de tratar a obesidade. Parece que uma composição de genes é responsável pela obesidade humana (Karen et al., 1998; Friedman, 2000).
Contudo, esta não é uma das maiores preocupações na produção animal. No entanto, a alteração da composição, através de repartidores de nutrientes, com maior deposição de tecido protéico, a fim de melhorar a eficiência produtiva é de interesse comum na cadeia da carne. A qualidade da carne, atualmente, consiste em uma importante questão na indústria desse setor. Consumidores interessam-se cada vez por mais produtos com maior suculência, sabor e maciez. Nesse sentido, a presença da gordura intramuscular na carne, pode contribuir de maneira direta nesses atributos de qualidade, ainda que seja difícil essa comprovação no Brasil (Luchiari, 2005). Assim, a busca por tecnologias, que visem selecionar animais superiores para essas características traz benefícios indiscutíveis para toda a cadeia da carne.
Dentre as novas tecnologias testadas encontra-se a leptina. Em 1995 e 1996 a leptina e seus genes foram descobertos como responsáveis pela síndrome da obesidade em ratos e clonada primeiramente em suínos (Bidwell at al., 1997).
Trata-se de um hormônio, que atua no controle da ingestão de alimentos e na composição corporal. Estudos realizados observaram que a redução de 10% do peso corpóreo, em humanos obesos, resultou na queda de 53% de leptina sérica (Considine et al., 1996) e 10% de aumento de peso corpóreo levou a um acréscimo de 300% de leptina sérica (Kolaczynski et al., 1996b). Portanto, sugere-se que a leptina não atue somente na função como um “adipostato” a fim de sinalizar o “status” de armazenamento de energia (no cerébro e demais tecidos), mas com a função de um sensor de balanço energético (Houseknecht et al., 1998).
O Crescimento e biologia da Leptina
A leptina é uma proteína de 16-kDa secretada de adipócitos brancos. Assim como os adipócitos aumentam em massa, a concentração periferal de leptina também aumenta (Ahima & Flier, 2000, citado por Geary et al., 2003). Uma vez que mamíferos atingem a maturidade, o crescimento subseqüente ocorre na forma de deposição de tecido adiposo. Portanto, parece que a concentração de leptina circulante também aumenta.
Essa proteína é sintetizada e secretada no sangue. É ainda transportada para o cérebro, onde atua na liberação, ou inibição de fatores, que resulta na redução do consumo, no aumento do dispêndio de energia e aumento da atividade física.
O tratamento de leptina em animais tem sido correlacionado com a redução da ingestão de alimentos, perda de peso corpóreo, redução dos depósitos de gordura e aumento do metabolismo energético. Esses efeitos foram observados, independente do modo de administração (central ou sistêmico) embora elevadas doses sejam requeridas em tratamentos sistêmicos (Levin et al., 1996; Campfield et al., 1995).
De acordo com Karen et al. (1998), a leptina pode ainda ser classificada como uma “modificadora do metabolismo”. Portanto, a manipulação da expressão e da ação da leptina é de interesse científico, na melhora e produção animal. Não obstante, está envolvida em respostas a algumas doenças, incluindo o estresse animal.
Pesquisas observaram que a administração exógena de leptina, em ratos, melhorou significantemente as funções endócrinas, bem como, a redução da ingestão de alimentos e a perda de peso corporal (Nkrumah, et al., 2005).
Em relação à expressão e a secreção da leptina, há uma alta correlação com a gordura corpórea e o tamanho do adipócito. O cortisol e a insulina são potentes estimuladores da expressão da leptina e essa expressão é atuada por b-agonistas adrenérgicos, dentre outros. Além disso, há uma associação entre a função de outros hormônios e fatores de crescimento na regulação da expressão secreção da leptina (Karen et al., 1998). Vários pesquisadores desenvolveram uma teoria lipostática para manutenção do peso. Estes pesquisadores propuseram um fator secretor de gordura, que relata o estado de energia armazenada no organismo para o cérebro e este regula a alimentação e a taxa de gordura corporal (Figura 01 e Figura 02).
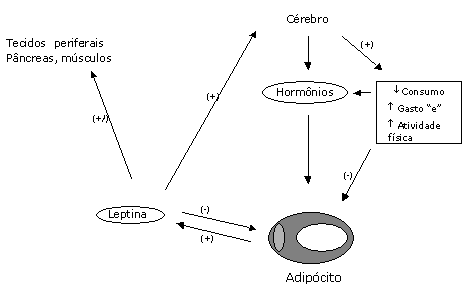
Figura 01- Secreção e ação da leptina. A leptina circula através do cérebro, atua na estimulação ou inibição de neurotransmissores, tais como neuropeptídeos Y (NPY), que inibem o consumo e estimulam a termogênese e a atividade física, resultando na redução da massa adiposa. A leptina pode agir diretamente nometabolismo e função de tecidos (fígado, pâncreas, músculos e adipócitos. (+) estimula; (-) inibe; (+/-) estimula ou inibe; aumenta; ¯diminui.
Fonte: Karen et al., 1998, adaptado.
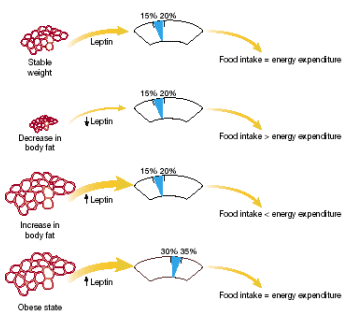
Figura 02 – Regulação da leptina no tecido adiposo. Em indivíduos com peso estável: o teor de leptina circulante (lc) é igual a energia dispendida (ed): (a). A redução de gordura corpórea relacionada aos menores níveis de (lc): (b). O aumento da (lc) resulta em balanço energético negativo (c). Uma sensitividade intrínseca à leptina é reduzida entre obesos e o teor de gordura corpórea é aumentado (30 a 35%): (d).
Fonte: Friedman, 2000. adaptado.
Leptina como preditora da composição da carcaça
O crescimento é definido como a produção de novas células. Porém, é tipicamente mensurado como um aumento da massa, que não inclui necessariamente a multiplicação das mesmas (hiperplasia), mas a ampliação (hipertrofia) e incorporação dos componentes específicos do ambiente. Por definição, o crescimento inclui a deposição de gordura, embora a deposição de proteína (músculos) seja de interesse primário na produção de carne. A maturidade é geralmente considerada o ponto em que a massa muscular atinge o limite máximo. Portanto, o ponto máximo de massa protéica e acúmulo da deposição de gordura ocorre excedente a esse ponto. (Owens et al., 1993, Garcia et al., 2003).
Contudo, alguns fatores podem interferir de forma direta, ou indireta na taxa de crescimento celular, tais como, ambiente, genética, doenças, comportamento (hierarquia), exercícios e hormônios podem influenciar no crescimento e na maturidade. Alguns desses fatores alteram ainda a concentração hormonal no sangue e no suprimento de nutrientes específicos no organismo. Especificamente, o crescimento, o manejo durante a fase de terminação, bem como a variação no período de coleta das amostras, a dieta e a idade ao realizar a castração, contribuem para as diferenças nos níveis e leptina entre bovinos (Geary et al., 2003).
Posteriormente, Gillis et al. (2004) concluíram que a manipulação da dieta alterou a concentração de leptina circulante, ou as características de carcaça, particularmente em ruminantes, consumindo dietas com elevado nível de concentrado.
Na indústria da carne, a hipertrofia do tecido adiposo, consiste em maior deposição de gordura, principalmente em animais em terminação. Todavia, a taxa de deposição de gordura varia, dependendo da localização no organismo. Por exemplo, em fase de crescimento, em bovinos, ovinos e suínos a hipertrofia da gordura subcutânea ocorre mais rapidamente do que a hipertrofia da gordura intermuscular, intramuscular, dos rins, pélvica e cardíaca (KPH) (Kempster 1980, citado por Geary et al., 2003).
Uma outra observação é que fêmeas apresentaram maiores escores de marmorização e pesos de KPH, sem aumento dos níveis de leptina, sugerindo que síntese de leptina e a degradação da mesma difere entre os sexos. Hellstrom et al. (2000), também relataram que mulheres possuem maiores concentrações de leptina circulante, em relação aos homens. Por outro lado, Berg et al. (2003) e Buff et al. (2002) encontraram resultados opostos em eqüinos e suínos.
Nesse sentido, o tamanho dos adipócitos pode influenciar na síntese e secreção de leptina, devido a maior proporção de RNAm leptina. Igualmente, o diâmetro varia dependendo da localização nos tecidos. Em estudos realizados com novilhos cruzados, com 17 meses de idade, observou-se que o diâmetro dos adipócitos foram classificados, dos maiores para os menores adipócitos: KPH, mesentérica, subcutânea, intermuscular, intramuscular e gordura da região da ponta de agulha, respectivamente (Cianzio et al., 1985).
Geary et al. (2003) com o objetivo de determinar se a concentração sérica de leptina (CSL) poderia ser utilizada para predizer a composição e a qualidade da carcaça em bovinos (Bos taurus) terminados em confinamento, não observaram diferenças na CSL. Porém, houve uma correlação positiva entre a CSL, escore de marmorização, espessura de gordura subcutânea (EGS), gordura renal, pélvica e cardíaca e o grau de qualidade em bovinos ¼ composto de gene combinante e o grupo com novilhos com deposição maior de músculos, respectivamente. Ainda, a CSL foi significativamente associada com a composição da carcaça e com o grau de qualidade nesses animais. Portanto, a CSL consistiu em um bom indicador de conteúdo de gordura em bovinos confinados.
A gordura intramuscular é de grande importância na qualidade da carne, pois influencia na palatabilidade, na maciez, na suculência e no sabor da carne, através do estímulo das glândulas salivares (Savell & Cross, 1988, citado por Geary et al., 2003). O número de adipócitos, preferivelmente o tamanho, influencia de modo direto no conteúdo da gordura intramuscular em bovinos e na concentração de leptina circulante em ratos. Sugere-se, que elevados níveis de leptina são indicativos de maiores adipócitos em bovinos.
Leptina e CLA
Em pesquisas desenvolvidas com espécies monogástricas, observou-se que a redução da proliferação dos adipócitos e leptina circulante, poderia associar-se à uma alimentação rica em CLA (acido graxo linoléico), um termo genérico para os isômertos do ácido linolêico (18:2) e linolênico (18:3) Devido ao fato do CLA ser um produto intermediário da biohidrogenação do 18:2 e 18:3 no rúmen, sua produção e acréscimo poderia ser aumentado com dietas ricas em 18:2 e 18:3 para bovinos. É importante ressaltar, que essas dietas elevam também o teor de colesterol sérico, insulina e GH (hormônio do crescimento). Todavia, esses efeitos parecem não se relacionar aos adipócitos e leptina sérica.
Garcia et al. (2003) sugeriram uma relação entre o aumento de ácido linoléico na dieta (5 e 7% de adição de gordura), como conseqüência, uma redução dos adipócitos e leptina sérica e atraso da puberdade. No entanto, os resultados encontrados neste trabalho, indicaram que a alimentação com dietas ricas em ácido linoléico, para o crescimento e avanço da fase de puberdade de novilhas, apresentou efeitos mínimos para as características de gordura total na carcaça, leptina circulante ou idade à puberdade, apesar dos níveis elevados de CLA. Assim, outros modelos de nutrição devem ser estudados para o entendimento da relação entre a função dos adipócitos e leptina na maturidade sexual.
Leptina e Carnitina
A carnitina é um composto fundamental para o transporte de ácidos graxos de cadeia longa para serem oxidados na mitocôndria. É sintetizada no fígado, rins e cérebro, mas também pode ser consumida em alimentos de origem animal, principalmente a carne vermelha. Sua maior concentração endógena está nos músculos esqueléticos. Sua forma ativa é a L-carnitina. Na situação de redução nos estoques de carboidratos a lipólise pode aumentar até duas vezes em comparação ao estado normal e a oferta de L-carnitina poderia acelerar o transporte dos ácidos graxos provenientes desta para o interior da mitocôndria (Gomes, et al., 2000).
Inúmeros estudos afirmam que, em várias espécies, a suplementação com L-carnitina influencia na composição corporal e na repartição de nutrientes no organismo (Heo et al., 2000).
Iossa et al. (2002) suplementaram ratos com acetil L-carnitina (ALCAR) e observaram uma redução dos níveis de leptina em ratos velhos. Portanto, esses resultados indicaram, que a suplementação com acetil L-carnitina influenciou na repartição de nutrientes de maneira diferente em ratos jovens e velhos, com menor deposição de lipídeos em ratos mais jovens, enquanto que a deposição de proteínas foi maior em ratos mais velhos. Embora esses trabalhos enfoquem a utilização de ratos, abrem-se muitas perspectivas para o estudo em humanos e na produção de ruminantes.
Considerações finais
O entendimento do mecanismo envolvido no controle do consumo e na regulação do balanço energético têm crescido nos últimos anos.
A descoberta da leptina, relacionada à deposição de gordura, é significativamente importante e inovadora. Cerca de 40% da população brasileira encontra-se acima do peso ideal. Os Estados Unidos gastaram cerca de 117 bilhões de dólares com obesos e doenças provocadas por obesidade (diabetes, hipertensão, doença coronariana, artroses). Portanto, não se trata somente de um problema individual, mas de saúde pública, devido aos custos elevados.
Especificamente, para a produção de ruminantes, a oportunidade de modificar a composição, através da seleção ou manejo poderia auxiliar produtores a oferecer carne, de acordo com as expectativas dos consumidores (maior ou menor presença de gordura na carne). Assim, a concentração de leptina circulante consiste em um importante indicador do conteúdo de gordura, possibilitando a implementação, ou ainda a reformulação de estratégias de manejo na produção animal.
Contudo, mais pesquisas devem ser desenvolvidas a fim de descobrir se a concentração sérica de leptina, associada à outros indicadores (CLA, carnitina) poderiam ser utilizados como preditores no valor da carcaça e serem aplicados no período pré-abate.
Trata-se, portanto, de um estudo inovador e um passo para o futuro na produção de ruminantes.
Referências bibliográficas
BERG, E.P.;. et al. Serum concentration of leptinin six genetic lines of swine and relationship with growth and carcass characteristics. J.Anim.Sci., v.81, p.167-171, 2003.
BIWELL, C.A; et al. Cloning and expression of the porcine obese gene. Anim. Biotechnol., V.8, p.191-206, 1997.
BUFF, P.R.; et al. Leptin in horses: Tissue localization and relation between peripheral concentrations and body condition. J.Anim.Sci., v.80, p.2942-2948, 2002.
CAMPFIELD, et al. Recombinant mouse OB protein: Evidencefor a peripheral signal linking adiposity and central neural networks. Science. V.269, p.546-549, 1995.
CONSIDINE, R.V. et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N.Engl.J.Med., v.334, p.292-295, 1996.
CIANZIO, D.S. et al. Adipose tissue growth and cellularity: changes in bovine adipocyte size and number. J.Anim. Sci., v.60, p.970-976, 1985.
FRIEDMAN, J.M. Obesity in the new millennium. Nature. v.404, p.632-634, 2000.
GEARY, T.W. et al. Leptin as a predictor of carcass composition in beef cattle. J.Anim. Sci., v.81, p.1-8, 2003.
GARCIA, M.R. et al. Age at puberty, total fat and conjugated linoleic acid content of carcass, and circulationg metabolica hormones in beef heifers fed a diet high in linoleic acid beginning at four months of age. J.Anim.Sci., v.81, p.261-268, 2003.
GILLIS, M.H. et al. Effects of supplemental rumen-protected conjugated linoleic acid or linoleic acid on feedlot performance, carcass quality, and leptin concentrations in beef cattle. J.Anim.Sci., v.82, p.851-859, 2004.
GOMES, M.R.; TIRAPEGUI, J. Relação de alguns suplementos nutricionais e o desempenho físico [on-line]. Arquivos Latinoamericanos de Nutrición. V.50, n.4, 2000. Disponível na internet via: www.scielo.org.ve, Arquivo capturado em 17/01/2005.
HELLSTROM, L.; WAHRENBERG, K.; et al. Mechanisms behind gender differences in circulating leptin levels. J. Intern Med., v.247, p.457-462, 2000.
HEO, K.; et al. Dietary L-carnitine improves nitrogen utilization in growing pigs fed low energy, fat-containing diets. J. Nutr., v.130, p. 1809-1814, 2000.
HOUSEKNECHT, K.L. et al. The biology of leptin: A review. J.Anim.Sci., v.76, p.1405-1420, 1998.
KAREN, L.; et al. The biology of Leptin: A Review. J.Anim.Sci., v.76, p.1405-1420, 1998.
KOLACZYNSKI, J.W.; et al. Responses of leptin to short-term fasting and prolonged overfeeding in humans. J.Clin.Endocrinol.Metab. V.81, p.4162-4165, 1996b.
LUCHIARI, FILHO, A. Mensagem pessoal. 19 de Janeiro de 2005.
NKRUMAH, C.; .et al. Polymorphisms in the bovine leptin promoter associated with serum leptin concentration, growth, feed intake, feeding behavior, and measures of carcass merit. J.Anim.Sci., v.83, p.20-28, 2005.
OWENS, F.N.; DUBESKI, P.; HANSON, C.F. Factors that alter the growth and development of ruminants. J.Anim.Sci., v.71, p.3138-3150, 1993.
A autora agradece ao Prof Dr Albino Luchiari Filho pela colaboração.
________________________________________________________
1Angélica Simone Cravo Pereira é pós-graduanda na FZEA/USP


