Sorgo: escolha de híbridos e adubação
25 de julho de 2003Angus Plus no Leilão São Leopoldo Mandic
25 de julho de 2003Maciez da Carne e Crescimento Muscular
Angélica Simone Cravo Pereira1
A fim de atender às expectativas dos consumidores, a indústria de carnes nos Estados Unidos tem identificado um constante problema de inconsistência na maciez da carne, como prioridade a ser resolvida, ou ainda minimizada, a fim de melhorar a qualidade da carne que os consumidores adquirem. Porém, isso requer um entendimento detalhado de todos os processos envolvidos, que alteram a maciez da carne, além de repassar essas informações à indústria da carne.
Iniciando pela década de 90, a indústria de carnes americana tem acelerado a adoção de novas tecnologias a fim de conhecer as expectativas dos consumidores. Por exemplo, enquanto produtos cárneos de algumas companhias já possuem a marca de “garantia de maciez”, alguns anos atrás, essa diferenciação nos produtos não poderia ser observada, tão pouco utilizada. Outro recente desenvolvimento dessas indústrias são os produtos marinados e preparados em bandejas (case ready). Isso indica o crescimento e a probabilidade da adoção de novas tecnologias implementadas pela indústria americana, para a melhora da inconsistência da maciez da carne.
A satisfação do consumidor ao degustar a carne (eating quality) é resultado da interação de diversos fatores, tais como, maciez, suculência e sabor. Entretanto, Koohmaraie, (1995) observou uma pequena variação relatada por consumidores, no que diz respeito à suculência e sabor ao degustar a carne. Portanto, a redução, ou eliminação da variação da maciez deveria ser o principal atributo na qualidade. Além desse importante atributo, pode-se citar também a conveniência do produto (disponibilidade, facilidade no preparo, como os produtos marinados e empanados) a estabilidade do mesmo (“vida de prateleira”, manutenção e a própria qualidade do produto) a segurança (carga microbiana, pureza, aspecto higiênico sanitário) e o valor nutritivo do produto (conteúdo nutricional, disponibilidade de nutrientes, valor calórico).
Porém, por quê avaliar esses atributos?
O sucesso do produto, seja ele qual for, é resultado, principalmente da aceitação do consumidor. Antigamente, a grande preocupação era em relação à qualidade no produto final. Contudo, atualmente há a preocupação com toda a cadeia produtiva, somando cada um dos diferentes aspectos: (qualidade nutricional, higiênica, ao degustar, microbiológica e qualidade ambiental). Entretanto, os objetivos desse trabalho foram rever os mecanismos de crescimento muscular, a base bioquímica para a maciez da carne e a relação entre esses dois importantes processos.
Considerações Iniciais
É comumente estudado o efeito da porcentagem de maciez da carne, que ocorre no primeiro dia pós-morte, aos três dias pós-morte, ou ainda o processo de amaciamento, que ocorre após os 3 dias pós morte, desde da redução, ou perda da atividade das calpaínas (proteases cálcio dependentes) envolvidas no processo de maciez da carne. Porém, o fato é que nenhuma dessas mudanças ocorre uniformemente entre os animais e subestimam a dinâmica da natureza das mudanças no processo pós-morte. Assim, considerando alguns dados, pesquisadores demonstraram as mudanças na força de cisalhamento (medida objetiva em kg utilizada para verificar a maciez da carne) do músculo Longissimus de ovinos abatidos e armazenados por 14 dias pós-morte (Figura 1).
Figura 1
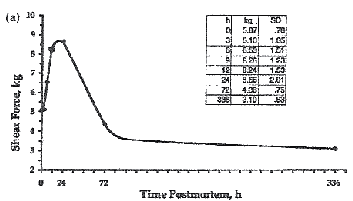
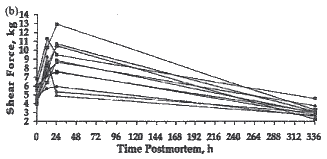
As médias dos valores da força de cisalhamento foram 8,66 kg. Através da interpretação desses dados, concluiu-se que, a carne desses animais 24 horas após o abate, foi extremamente dura, que o processo de maciez ainda não havia ocorrido e por fim, que o amaciamento da carne desses animais começou somente 24 horas pós-morte (Figura 2). Ainda, a extensão dos valores da força 24 horas após o abate foi de 5 a 13 kg. Porém, é importante não generalizar tais informações, que podem levar à conclusões erradas. Neste exemplo, somente 3 amostras da carne de ovinos, do total de 11 amostras foram consideradas muito macias 24 após o abate, duas aceitáveis e seis amostras consideradas duras. Portanto, 5 dos 11 animais apresentaram carne muito macia após as primeiras 24 horas.
Figura 2
Crescimento Muscular
A hiperplasia (aumento do número de células) e hipertrofia (aumento do tamanho das células) são determinantes no processo de crescimento de massa muscular. Se definirmos o processo de hiperplasia, como número atual de células, é controlado por proliferação de células embriônicas. Contudo, se a hiperplasia for definida como conteúdo de DNA, então será determinada pela proliferação de células pré-natal e crescimento pós natal e ainda desenvolvimento de células satélites. Portanto, animais nascidos com um grande número de células musculares (por exemplo, bovinos com dupla musculatura) teriam um maior potencial muscular. Ainda, animais em que as células satélites são mais ativas poderiam potencialmente obter maiores massas musculares. A maior parte do conteúdo de DNA do músculo é acumulado durante o crescimento e desenvolvimento muscular pós-natal, que é o resultado direto da atividade das células satélites. Ainda, o tamanho do músculo é determinado pelo balanço entre a quantidade de proteína sintetizada e a quantidade de proteína degradada. Qualquer possível combinação, que resulte em balanço positivo desta equação (acréscimo de proteína muscular = quantidade de proteína sintetizada-quantidade de proteína degradada) poderia resultar em hipertrofia muscular.
Cenários que podem levar à hipertrofia muscular:
1 – Aumento da síntese de proteína e redução da degradação de proteína
2 – Aumento da síntese protéica e degradações protéicas, promovendo um aumento na síntese, maior que o aumento na degradação (método menos eficiente para aumentar a taxa de crescimento muscular)
3 – Redução da síntese e degradação protéica, produzindo um decréscimo na degradação protéica, sendo maior que o decréscimo na síntese (método mais eficiente para aumentar a taxa de crescimento muscular).
Dessa forma, como citado, a contribuição da síntese protéica para o acréscimo de proteína seria, talvez, uma importante contribuição da degradação protéica para o acréscimo de proteína. Entretanto, há a necessidade de um perfeito entendimento de todos os processos que regulam a degradação protéica dos músculos. Além disso, há uma relativa contribuição de ambos processos de hiperplasia e hipertrofia na variação da maciez da carne após o período pós-morte, que será previamente discutido.
Os músculos consistem de três frações protéicas, miofibrilar (solúvel em sal), tecido conjuntivo (solúvel em ácido e termoestável) e proteína sarcoplasmática (solúvel em água). Porém, o foco principal neste trabalho é em relação à regulação da degradação das proteínas miofibrilares, pois consiste da maior fração protéica do músculo esquelético e o estado das miofibrilas poderia explicar a maior variação na maciez do músculo Longissimus (considerado o maior músculo de importância econômica). Porém, isso não quer dizer que o tecido conjuntivo não contribua para a maciez da carne. Contudo, Marsh, (1977) observou uma pequena variação na maciez do músculo Longissimus após 14 dias de estocagem. Ainda, as proteínas sarcoplasmáticas, da mesma maneira, não alteraram diretamente a maciez da carne.
Outros pesquisadores, como Goll et al. (1989) demonstraram a importância da degradação das proteínas na eficiência da deposição de carne magra. Eles observaram que 10% da taxa de redução da degradação protéica (de 3% por dia para 2,7% por dia) poderia resultar no dobro da taxa de ganho em um animal com, por exemplo, 454 kg. O decréscimo da taxa de degradação protéica poderia resultar em significante aumento na eficiência da deposição de proteína no músculo (Goll et al., 1989). Conseqüentemente, elucidando os fatores, que regulam a degradação protéica miofibrilar durante o crescimento e desenvolvimento e mais importante, o desenvolvimento da habilidade em manipular a vantagem desses fatores poderia permitir um significante aumento na eficiência de produção.
Mecanismo de “Turnover”
O complexo processo de quebra das proteínas miofibrilares e seus agentes envolvidos, ainda não são claramente entendidos.
Alguns modelos, como estudado por Goll et al. (1992) poderiam explicar tal comportamento. Segundo esses pesquisadores, o músculo para permanecer funcional, o processo deveria ocorrer na superfície das miofibrilas e o primeiro passo para o mecanismo de “turnover” das proteínas miofibrilares na maturação do músculo esquelético seria provavelmente a congregação (reunião) das miofibrilas para o interior dos miofilamentos. Estes miofilamentos são subseqüentemente degradados em polipeptídeos e aminoácidos livres. Ainda, por serem facilmente removidos, alguns pesquisadores denominaram estes miofilamentos de ERM (Easily Released Myofilaments). Portanto, tratamentos, que elevassem o “turnover” das proteínas miofibrilares, aumentariam a fração de ERM.
Em adição, com os níveis de ERM elevados no músculo, aumentariam a atividade das calpaínas (Belcastro, Scrubb & Gilchrist, 1991). Porém, o problema, de acordo com Goll et al. (1998), é que o proposto não avalia o “turnover” das proteínas no interior das miofibrilas.
Em relação às proteases, há três componentes: calpaínas, proteassomas e sistema proteolítico de lisossomas. Porém, existem controvérsias na relação dessas proteases com a degradação das miofibrilas. Contudo, uma vez que os miofilamentos são deslizados para as proteínas, ambas, catepsinas lisossômicas e proteassomas são capazes de converter rapidamente proteínas miofibrilares em aminoácidos.
Maciez da Carne
Têm-se estudado, que o estado de contração das miofibrilas musculares tem efeito na maciez do músculo. Pesquisas reportaram, que as velocidades de resfriamento do músculo, do declínio de pH pós-morte e a extensão final na contração medida como comprimento do sarcômero (este fenômeno é denominado encurtamento pelo frio ou endurecimento induzido pelo frio) alteram a maciez da carne. Estes estudos mostram, que músculos com sarcômeros mais curtos são mais duros. As velocidades de declínio da temperatura e pH dentro do músculo são alteradas pela temperatura do ambiente, velocidade do ar, peso, volume da carcaça e quantidade de gordura, que atua como isolante térmico da carcaça (Marsh et al., 1977).
Evidências recentes sugerem, que a proteólise das proteínas miofibrilares é a causa do processo de amaciamento da carne. Essas proteínas envolvidas são: (1) cadeia inter-miofibrilar (desmina e vinculina) (2) intra-miofibrilar (titina, nebulina e possivelmente troponina- T) (3) ligação de miofibrilas no sarcolema por costâmeros (vinculina e distrofina) e (4) a anexação das células musculares para a lâmina basal (laminina e fibronectina). A função dessas proteínas é manter a integridade estrutural das miofibrilas. A degradação dessas proteínas poderia causar enfraquecimento das miofibrilas, levando ao processo de amaciamento da carne (Koohmaraie et al., 2002).
Dentre as características, que influenciam a atividade das calpaínas, o pH desempenha um papel importante no amaciamento da carne, como seria esperado em qualquer processo enzimático. As calpaínas têm atividade máxima, in vitro, em pH neutro (Delgado, 2001).
Maciez da Carne e Crescimento Muscular
Se o crescimento muscular é resultado da hiperplasia (aumento do número de células durante o desenvolvimento embriônico e/ou aumento do conteúdo de DNA devido à atividade das células satélites) poderia haver um efeito não negativo ou ainda positivo no processo de maciez da carne. O melhor exemplo para essa afirmação seria bovino com a presença de dupla musculatura. A dupla musculatura em bovinos é resultado da inativação da mutação no gene miostatina (Koohmaraie et al., 2002) resultando na supressão da inibição da proliferação das células embriogênicas (consequentemente, animais nascidos com maior número de fibras musculares). Além disso, animais com dupla musculatura também possuem maior capacidade para sintetizar proteínas musculares. Ainda, bovinos com uma cópia da miostatina inativada, relacionados com bovinos com a miostatina desativada, possuem rendimento 7% maior e duas cópias desse gene acarretaram em 20% a mais no rendimento da carne desses animais (Wheeler et al., 2001). Entretanto, a carne de bovinos portadores desse gene inativado é mais macia na maior parte dos músculos, especialmente em músculos em que o conteúdo de tecido conjuntivo é o maior determinante da maciez da carne (Koohmaraie et al., 2002).
Além disso, se a hipertrofia muscular é devido a mudanças na síntese de proteínas, não poderia haver um efeito negativo no processo de maciez da carne, pois os fatores reguladores da síntese protéica não estariam envolvidos na regulação da maciez e amaciamento da carne. Assim, bovinos com dupla musculatura presente, consistem em um exemplo do efeito da síntese de proteína na maciez da carne. De todos os mecanismos possíveis de aumento de deposição de músculo, somente o mecanismo que envolve a supressão da degradação da proteína poderia resultar na redução do processo de maciez da carne.
Infelizmente, a supressão da degradação protéica parece ser o mecanismo que é responsável pelas diferenças nas taxas de crescimento muscular dos animais domésticos (Koohmaraie et al., 1995, citado por Koohmaraie et al., 2002).
Alguns exemplos reafirmam o efeito negativo da supressão da degradação da proteína miofibrilar na maciez da carne: O primeiro é a mutação genética em ovinos denominados callipyge e o segundo é a manipulação da dieta e o fornecimento de adrenérgicos Beta-agonistas em algumas espécies (Climaterol, Clenbuterol) para animais produtores de carne.
Em relação às características de ovinos callipyge, relata-se, que a hipertrofia de músculos induzidos callipyge é mantida através da redução da degradação protéica (Lorenzen, 2000) e em segundo, o efeito relativo da condição de callipyge no peso de vários músculos é proporcional à atividade da calpastatina. Ainda, em terceiro, a dureza da carne desses animais resulta da redução e extensão da taxa de proteólise e amaciamento pós-morte.
Em relação ao efeito da administração de adrenérgicos Beta-agonistas no crescimento muscular e na maciez da carne, de acordo com diversos pesquisadores, é similar ao efeito dos genes callipyge no crescimento dos músculos e na maciez da carne (aumento da atividade da calpastatina, redução da proteólise pós-morte, aumento da dureza da carne). A hipótese é que, no músculo vivo, a elevação da supressão da calpastatina, mi-calpaína (e talvez m-calpaína), que por sua vez, reduz a taxa de degradação protéica, resulta em um aumento do crescimento muscular.
Ainda, considerando o modelo callipyge, se a hipertrofia muscular fosse causada pela redução da degradação protéica, se poderia esperar um aumento da dureza da carne, ocorrendo somente em músculos hipertrofiados, os quais a maciez é alterada por mudanças na proteólise pós-morte (por exemplo, M. Longissimus). Por outro lado, a proteólise pós-morte tem um efeito mínimo na maciez do M. psoas major, pois esse músculo possui sarcômeros muito longos. Consequentemente, a mutação de callipyge não alteraria a maciez desse músculo (Koohmaraie et al., 2002).
Baseando-se nesta discussão, há duas calpaínas mediadas a fim de favorecer o crescimento muscular. Se o objetivo é aumentar massa muscular sem qualquer relação positiva com a maciez da carne (carne moída ou qualquer músculo, já considerado macio) podería-se selecionar animais com alta atividade de calpastatina. Porém, se o objetivo é aumentar o crescimento muscular sem qualquer efeito adverso na qualidade da carne, então um modelo trangênico seria mais apropriado. Dessa forma, poderia-se produzir animais com a habilidade acentuada em expressar a atividade da calpastatina no músculo esquelético, durante a fase de crescimento e então bloquear esta atividade antes do período de abate desses animais. Assim, a razão para enfocar o modelo mediado por calpaínas é que a supressão da degradação da proteína, sem qualquer efeito na síntese protéica é energeticamente eficiente. Outra possibilidade a ser explorada seria a seleção de animais com alta atividade de células satélites, já citadas anteriormente.
Conclusões
Embora evidências indiretas suportem o mecanismo proposto do “turnover” das proteínas miofibrilares e a função das calpaínas neste processo, é essencial observar, que não há evidências diretas, que afirmem a teoria citada. Assim, é importante o desenvolvimento de experimentos, que visem manipular o sistema proteolítico das calpaínas, e ainda a quantificação dessas proteínas.
Dessa forma, a demonstração dessas hipóteses deve preconizar a redução do impacto da inconsistência da maciez na cadeia produtiva da carne, através da regulação da degradação das proteínas no músculo bovino.
Referências Bibliográficas
BELCASTRO, A. N.; SCRUBB, J.; GILCHRIST, J.S. Regulation of ATP-stimulated releasable myofilaments from cardiac and skeletal muscle myofibrils. Molecular and Cellular Biochemistry, v.103, p.113-120, 1991.
DELGADO, E.F. Fatores bioquímicos que afetam a maciez da carne. In: 1º Congresso Brasileiro de Ciência e tecnologia de Carnes. Anais. São Pedro. p. 143-159, 2001.
GOLL, D.E.; KLEESE, W.C.; SZPACENKO, A. Skeletal muscle proteases and protein turnover. Animal growth regulation. New York: Plenum publishing. p.141-182, 1989.
GOLL, D.E.; THOMPSON, V.F.; TAYLOR, R.G.; CHRISTIANSEN, J.A. Role of the calpain system in muscle growth. Biochimie. V.74, p.225-237, 1992.
GOLL, D.E.; THOMPSON, V.F.; TAYLOR, R.G.;OUALI, A. The calpain system and skeletal muscle growth. Canadian Journal of Animal Science, v.78, p.503-512, 1998.
KOOHMARAIE, M.; KENT, P.M.; SHACKELFORD, S.D.; VEISETH, E.; WHEELER, T.L. Meat tenderness and muscle growth: is there any relationship? Meat Science, v.62, p.345-352, 2002.
KOOHMARAIE, M. The biological basis of meat tenderness and potential genetic approaches for its control and prediction. Proceedings of the Reciprocal Meat Conference, v.48, p.69-75, 1995.
LORENZEN, C.L.; KOOHMARAIE, M.; SHACKELFORD, S.D.; JAHOOR, F.; FREETLY, H.C.; WHEELER, T.L.; SAVELL, J.W.; FIOROTTO, M.L.; Protein kinetics in callipyge lambs. J.Anim Sci., v.78, p.78-87, 2000.
MARSH, B.B. The nature of tenderness. Proceedings of Reciprocal Meat Conference, v.30, p.64-47, 1977.
WHEELER, T.L.; SHACKELFORD, S.D.; CASAS, E.; CUNDIFF, L.V.; KOOHMARAIE, M. The effects of Piedmontese inheritance and myostatin genotype on the palatability of longissimus thoracis, gluteus medius, semimenbranosus, and biceps femuris. J. Anim. Sci., v.79, p.3069-3074, 2001.
______________________________________
1Angélica Simone Cravo Pereira é pós-graduanda em Qualidade e Produtividade Animal, FZEA – USP, Pirassununga.


