Austrália vê pequenos ganhos de acordo de livre comércio com EUA
13 de maio de 2004São Paulo vacinou 99,42% do rebanho contra aftosa em 2003
14 de maio de 2004CLA, carne bovina e saúde
O ácido linoléico conjugado (CLA), um derivado natural do ácido graxo linoléico tem recebido bastante atenção dos pesquisadores nos últimos anos. Começando por seus efeitos anticâncer, seus potenciais benefícios têm se estendido para propriedades anti-ateriogênicas (redução do risco de desenvolvimento da aterosclerose que, por sua vez, é o depósito de uma camada gordurosa na parede das artérias), propriedades antidiabéticas, melhora na resposta imunológica e efeitos positivos na distribuição de energia e crescimento. Estes efeitos têm sido documentados em várias revisões (1-4), bem como em uma extensiva literatura que cresceu exponencialmente desde o final da década de oitenta (5). Como um composto de ocorrência natural nos alimentos originados de animais ruminantes, as propriedades anticarcinogênicas do CLA são únicas.
Estrutura química
O CLA é um termo coletivo usado para descrever uma mistura de isômeros/formas posicionais e geométricas do acido linoléico. O ácido linoléico é um ácido graxo insaturado com 18 carbonos com duplas ligações nas posições 9 e 12, ambas em uma configuração “cis” (do mesmo lado). O nome químico do ácido linoléico é cis-9, cis-12-ácido octadecadienóico. Em contraste, as duas duplas ligações no CLA são primariamente nas posições 9 e 11 e 10 e 12, junto com uma cadeia de carbono com designação de dieno conjugado. Além destas diferenças na posição das duplas ligações, também podem ter mudanças geométricas (de configuração cis (c) ou trans (t) – lados opostos). Desta forma, pelo menos oito diferentes CLA isômeros foram identificados. Destes isômeros, a forma c9, t11 é a que se acredita ser a forma natural mais comum do CLA, com atividade biológica. Entretanto, nos últimos anos, a atividade biológica tem sido proposta por outras formas, especialmente o isômero t10, c12. Apesar de não amplamente aceito, o nome “ácido rumênico” tem sido proposto como um “nome comum” para o principal isômero do CLA encontrado em produtos naturais (6). Para uma comparação destas formas isômeras do CLA com o ácido linoléico, observe a figura 1. Isômeros potencialmente ativos adicionais estão também sendo identificados e estudados (2,7).
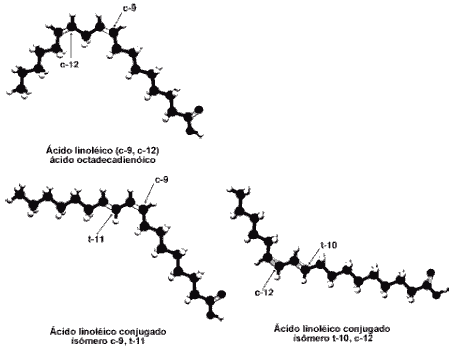
Figura 1: Estruturas químicas do ácido linoléico e de dos isômeros do CLA
Adaptado de: Steinhart, C. Conjugated Linoleic Acid The Good News about Animal Fat. J.Chem.Educ. 73:A302; 1996.
História, identificação e fontes
O CLA é um ácido graxo que ocorre naturalmente em alimentos originados de animais ruminantes. Apesar de ter sido identificado há muito tempo, o interesse por esta substância aumentou após ter sido isolada e identificada por Pariza e colaboradores como uma substância anticarcinogênica originada de carne bovina moída grelhada (8-10). Também se descobriu que o CLA está presente em uma série de produtos lácteos (11).
O teor total de CLA nos alimentos pode variar amplamente. Concentrações representativas e relativas de CLA em uma série de alimentos estão resumidas na Tabela 1. As concentrações de CLA são mais altas em alimentos de ruminantes (incluindo carne bovina, ovina e produtos lácteos). Frutos do mar, carne suína, a maioria dos produtos derivados de frangos e óleos vegetais não são fontes notáveis de CLA (12).
O CLA pode ser encontrado em triglicerídeos, lipoproteínas e em fosfolipídios de membranas celulares em vários tecidos de roedores, coelhos e humanos (2). Estudos anteriores sugerem que o teor de CLA pode ser aumentado em alimentos que são processados pelo calor (lácteos pasteurizados, carnes fritas, etc.) (11). Entretanto, estudos feitos posteriormente (13) sugerem que o CLA não aumenta com a cocção, mas sim, com a perda de água, o CLA permanece constante em uma base de gordura por grama. Adicionalmente, o CLA é estável e não destruído pela cocção ou estocagem.
Alimentos originados de animais ruminantes geralmente tem níveis de CLA em uma faixa de 3-7 miligramas por grama de gordura; no entanto, estudos recentes mostraram que é possível aumentar estes níveis “naturais” de ocorrência (4,14-16).
Tabela 1: Concentrações representativas/relativas de CLA em alimentos não cozidos (adaptado de Chin et al. (12)

Efeitos anticarcinogênicos – estudos com células e com animais
Após a identificação inicial do CLA como um modulador da mutagênese e da carcinogênese, o interesse das pesquisas acelerou. Estudos adicionais confirmaram o efeito anticarcinogênico em tecidos variados, especialmente na pele e no estômago. Contínuos estudos com uma ampla variedade de culturas de células e linhagens de células cancerosas (incluindo melanomas malignos, câncer cólon-retal, câncer de mama, adenocarcinoma no pulmão, câncer de próstata, leucemia, cânceres de ovário e fígado) demonstraram uma inibição pelo CLA (3, 17-20). Em contraste, o ácido linoléico não inibiu o crescimento de qualquer linhagem de células e, em alguns casos, estimulou o crescimento do tumor e a metástase (18,21).
Talvez o mais significante dos efeitos anticarcinogênicos do CLA tenha sido descrito por Ip e seus colaboradores (22,23), onde o CLA preveniu o câncer de mama em roedores quando foi administrado na dieta, antes da administração da substância carcinogênica. Este estudo foi diferente dos anteriores, que usaram doses agudas através de contato direto, administração não por via oral ou via adições de culturas de células. Estes estudos dietéticos mostraram uma proteção dose-dependente em níveis de 1% de CLA e abaixo, mas não foram mostrados efeitos benéficos em níveis acima de 1%. Em estudos com CLA dietético a 0,05, 0,1, 0,25 e 0,5%, a dose de 0,1% de CLA foi suficiente para causar uma redução significante em tumores mamários. Isso confirma o potencial do CLA como um poderoso anticarcinogênico, que poderia ser administrado de forma segura via dieta para se obter proteção contra o câncer, em um modelo animal.
Para colocar em perspectiva, o efeito do CLA (na gordura animal) na prevenção do câncer é específico e mais poderoso do que qualquer outro ácido graxo na modulação do desenvolvimento do tumor (1). Por exemplo, diferentemente do ácido linoléico (relativamente próximo do CLA) que às vezes estimula a carcinogênese (21), o CLA é inibitório. Além disso, os ácidos graxos n-3 dos óleos de peixe, que geralmente são responsáveis pela supressão de tumores, requerem uma presença de 10% na dieta para produzir as mesmas respostas de supressão de tumores. Em contraste, o CLA em níveis de apenas 0,1% na dieta produziu uma redução significante no câncer de mama em estudos com animais.
Outros trabalhos feitos por Ip e seus colaboradores mostraram que o momento de administração do CLA pode ser crítico. Por exemplo, quando o CLA é dado durante o período em que o tecido mamário está se desenvolvendo ativamente, vê-se um efeito protetor mais estável. Se o CLA é administrado depois da administração do carcinogênico, é necessário um fornecimento contínuo de CLA para que haja o efeito protetor. O CLA parece ter um impacto importante na glândula mamária, tornando o tecido menos susceptível à formação de tumor (4, 23, 24).
Continuam sendo feitos trabalhos para determinar o mecanismo exato pelo qual o CLA pode ter efeito no metabolismo carcinogênico, ativação ou detoxificação (2,3,25). Estudos com ratos onde foi dado CLA antes da administração de amina heterocíclica (substância cancerígena), mostraram reduções nos adutos de DNA (ligações covalentes formadas na molécula de DNA, determinando uma mutação) induzidos quimicamente em fígado, pulmão, intestino delgado e grosso, rins e cólon (26,27). O CLA em níveis equivalentes a 0,5% da dieta exerceu efeitos inibitórios no processo de carcinogênese no cólon (27).
Outros potenciais efeitos benéficos do CLA
Anti-aterogênico e hipocolesterolêmico
Vários estudos foram feitos para avaliar o efeito do CLA na aterogênese experimental em coelhos baseados na possibilidade de que o CLA pudesse ter atividade antioxidante (29). Quando o CLA foi adicionado a 0,5% a uma dieta ateriogênica, por 12 semanas, as aortas dos coelhos alimentados com CLA exibiram menos aterosclerose. Além disso, os níveis de colesterol LDL (lipoproteína de baixa densidade, do inglês low-density lipoprotein), chamado de colesterol “ruim”, pois transporta o colesterol para o organismo, depositando-o nas artérias, e de triglicerídeos foram mais baixos no grupo de animais alimentado com CLA (29).
Esta observação foi posteriormente apoiada por estudos em hamsters nos quais os animais alimentados com CLA tiveram igualmente menores níveis de colesterol LDL e de triglicérides no sangue. Os animais alimentados com CLA também tiveram menos formação de estria de gorduras nas artérias (acúmulos locais de células ricas em lipídio nas artérias, particularmente observadas em pontos de ramificação de vasos. Trata-se da lesão aterosclerótica mais freqüente).
Distribuição de gordura e metabolismo
Um dos efeitos mais interessantes do CLA parece ser sua influência nos níveis de gordura corpórea e na proporção de massa magra e de gordura, especialmente em animais jovens em crescimento. O CLA induz a um decréscimo relativo nos níveis de gordura corpórea e a um aumento da massa muscular magra. Esta observação tem sido notada em vários estudos com ratos, camundongos, pintinhos e porcos (4, 31-33). Em um estudo feito com porcos em crescimento, os resultados foram bastante dramáticos. A espessura da gordura do dorso foi reduzida em até 27% em porcos alimentados com CLA e houve um aumento de 6,8% na porcentagem de massa magra (33). Estes resultados geraram um considerável interesse em saber se em humanos ocorrem reduções similares de gordura e aumentos na proporção de massa muscular se o CLA foi consumido na dieta. Estudos em humanos estão atualmente sendo realizados (4).
Efeitos na resposta imune e na formação dos ossos
Os efeitos do CLA na distribuição de gordura podem ser, pelo menos parcialmente, resultados da modulação do sistema imune. Geralmente, a estimulação do sistema imune produz citoquinas (proteínas liberadas pela célula quando em contato com um antígeno, agindo como um mediador) que pode causar um rompimento em células musculares. O CLA pode modular (reduzir) a produção de citoquinas e, desta forma, evitar a degradação muscular. Experimentos com pintinhos, ratos e camundongos mostraram que o CLA aumenta a eficiência alimentar e combate à caquexia imuno-induzida e à má nutrição (4, 31, 34). Através destes efeitos nas citoquinas, o CLA pode também ter efeitos positivos na saúde dos ossos (4, 35, 36). Dietas ricas em gorduras contendo CLA, comparadas com óleo de soja, levam a uma maior taxa de formação de ossos (4).
Efeitos antidiabéticos
Também foi demonstrado que o CLA ajuda a normalizar ou reduzir os níveis de glicose sangüínea e possivelmente prevenir a diabetes (37). Usando modelos em animais de laboratório para diabetes, o CLA mostrou prevenir o início da doença. Parece que o CLA age como uma nova classe de medicamento contra a diabetes (tiazolidinediones, que aumenta a sensibilidade aos efeitos da insulina e reduz a quantidade de açúcar produzida pelo fígado) e pode fornecer uma vantagem adicional na redução do peso, uma vez que os tratamentos com drogas freqüentemente resultam em ganho de peso. Estas descobertas iniciais sobre diabetes em ratos são bastante encorajadoras e estão servindo de base para estudos em humanos.
Ingestão comum na dieta
Medidas atuais sobre as ingestões dietéticas comuns ou reais de CLA são muito limitadas, sendo na maioria das vezes estimadas. Uma lista de dados publicados em trabalhos baseados em estimativas está apresentada na Tabela 2 (10, 45-49).
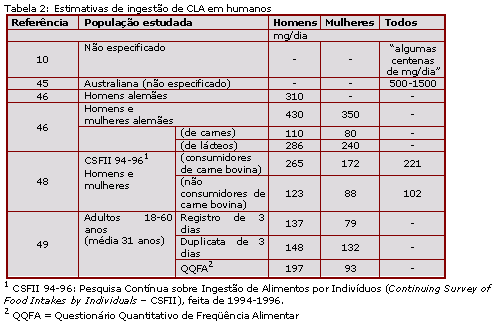
Uma variedade de fatores pode influenciar estimativas de ingestão de CLA. A composição dos alimentos e a freqüência de ingestão de alimentos particulares afetam a ingestão diária de qualquer componente alimentar. Para o CLA, deve ser adicionada a variação no nível de formas/isômeros biologicamente ativos de CLA consumido. Além disso, os homens normalmente consomem mais carne do que as mulheres; os alimentos lácteos geralmente fornecem maiores porcentagens de CLA dietético do que a carne bovina; e os indivíduos podem ser consumidores de carne bovina ou de lácteos ou não. Ainda, estimativas de ingestão podem estar baseadas em hipóteses de proporções dietéticas, como nos estudos alemães de carne/produtos de carne (40/60) e carne suína/bovina (80/20) (47).
Em outro estudo (48), dados disponíveis sobre o teor de CLA nos alimentos foram aplicados aos dados de consumo da CSFII 94-96 do USDA. Baseado nos dados de ingestão deste grande banco de dados estima-se que aproximadamente 36% da ingestão total de CLA é proveniente da carne bovina e aproximadamente 52%, de produtos lácteos.
Carne bovina como fonte de CLA
Uma dieta razoável, contendo carne bovina, pode fornecer os níveis benéficos de CLA, considerando que a dose mínima efetiva ainda é desconhecida? Até o presente, a resposta é “provavelmente”. Porém mais estudos ainda são necessários para determinar os níveis mínimos efetivos de CLA. Estudos animais têm mostrado benefícios de níveis dietéticos de apenas 0,1%-0,5%. Além disso, o potencial de dietas com níveis aumentados de CLA (mas ainda “naturais”), derivadas de carne bovina e produtos lácteos está agora sendo explorado (4). Foi mostrado que uma série de componentes da dieta para os bovinos podem aumentar os níveis de CLA na carne e no leite. Isso inclui: ingestão de plantas consumidas na pastagem, forragens e óleos insaturados de plantas (com o óleo de girassol resultando na maioria do CLA). Aumentos no teor de CLA no tecido de bovinos de corte estão atualmente sendo explorados, com indicações preliminares de que as elevações no teor de CLA são possíveis através de manejos nutricionais nos animais (16).
Referências bibliográficas
1.) Ip, C.; Scimeca, J.A.; Thompson, H.J. Conjugated linoleic acid. A powerful anticarcinogen from animal fat sources. Cancer. 74:1050- 1054; 1994.
2.) Belury, M.A. Conjugated dienoic linoleate: a polyunsaturated fatty acid with unique chemoprotective properties. Nutr. Rev. 53:83- 89:1995.
3.) Parodi, P.W. Milk fat conjugated linoleic acid: can it help prevent breast cancer? Proceed. Nutr. Soc. New Zealand. 22:137-149; 1997.
4.) Doyle, E. Scientific forum explores CLA knowledge. INFORM 9(1):69-73; 1998.
5.) Food Research Institute, University of Wisconsin, Madison. References on conjugated linoleic acid (CLA). FRI home page, (http:// www.wisc.edu/fri/clarefs.htm) 1998.
6.) Kramer, J.K.G.; Parodi, P.W.; Jensen, R.G.; Mossoba, M.M.; Yurawecz, M.P.; Adlof, R.O. Rumenic acid: a proposed common name for the major conjugated linoleic acid isomer found in natural products. Lipids 33:835; 1998.
7.) Yurawecz, M.P.; Roach, J.A.G.; Sehat, N.; Mossoba, M.M.; Kramer, J.K.G.; Fritsche, J.; Steinhart, H.; Ku, Y. A new conjugated linoleic acid isomer, 7 trans, 9 cis-octadecadienoic acid, in cow milk, cheese, beef and human milk and adipose tissue. Lipids 33:803-809; 1998.
8.) Pariza, M.W.; Loretz, L.J.; Storkson, J.M.; Holland, N.C. Mutagens and modulator of mutagenesis in fried ground beef. Cancer Res. 43:2444s-2446s;1983.
9.) Pariza, M.W.; Hargraves, W.A. A beef-derived mutagenesis modulator inhibits initiation of mouse epidermal tumors by 7,12- dimethylbenz[a]anthracene. Carcinogenesis 6:591-593; 1985.
10.) Ha, Y.L.; Grimm, N.K.; Pariza, M.W. Anticarcinogens from fried ground beef: heat-altered derivatives of linoleic acid. Carcinogenesis 8:1881-1887; 1987.
11.) Ha, Y.L.; Grimm, N.K.; Pariza, M.W. Newly recognized anticarcinogenic fatty acids: identification and quantification in natural and processed cheeses. J. Agr. Food Chem. 37:75-81; 1989.
12.) Chin, S.F.; Liu, W.; Storkson, J.M.; Ha, Y.L.; Pariza, M.W. Dietary sources of conjugated dienoic isomers of linoleic acid, a newly recognized class of anticarcinogens. J. Food Comp. Anal. 5:185-197; 1992. tumor cell lines is in part due to increased lipid peroxidation. Anticancer Research 15:1241-1246; 1995.
13.) Shantha, N.C.; Crum, A.D.; Decker, E.A. Evaluation of conjugated linoleic acid concentrations in cooked beef. J.Agric. Food Chem. 42(8):1757-1760; 1994.
14.) Kelly, M.L.; Berry, J.R.; Dwyer, D.A.; Griinari, J.M.; Chouinard, P.Y.; Vanamburgh, M.E.; Bauman, D.E. Dietary fatty acid sources affect conjugated linoleic acid concentrations in milk from lactating dairy cows. J. Nutr. 128:881-885; 1998.
15.) Dhiman, T.R.; Satter, L.D.; Pariza, M.W.; Gali, M.P.; Albright, K. Conjugated linoleic acid (CLA) content of milk from cows offered diets rich in linoleic and linolenic acid. J. Dairy Sci. 80(suppl 1):184 (abstr.); 1998.
16.) Dhiman, T.R. Dietary influence on conjugated linoleic acid content of milk and meat. AOCS 89th Annual Mtg. Presentation, (abstr.); 1998.
17.) Shultz, T.D.; Chew, B.P.; Seaman, W.R.; Luedecke, L.O. Inhibitory effect of conjugated dienoic derivatives of linoleic acid and bcarotene on the in vitro growth of human cancer cells. Cancer Letters 63:125-133; 1992.
18.) Schonberg, S.; Krokan, H.E. The inhibitory effect of conjugated dienoic derivatives (CLA) of linoleic acid on the growth of human tumor cell lines is in part due to increased lipid peroxidation. Anticancer Research 15:1241-1246; 1995.
19.) Visonneau, S.; Cesano, A.; Tepper, S.A.; Scimeca, J.; Kritchevsky, D. Effect of different concentrations of conjugated linoleic acid (CLA) on tumor cell growth in vitro. FASEB J. 9:A869; 1996.
20.) Yoon, C.S.; Ha, T.Y.; Rho, J.H.; Sung, K.S.; Cho, I.J. Inhibitory effect of conjugated linoleic acid on in vitro growth of human hepatoma. FASEB J. 11:A578; 1997.
21.) Ip, C.; Carter, C.A.; Ip, M.M. Requirement of essential fatty acid for mammary tumorigenesis in the rat. Cancer Res. 45:1997-2001; 1985.
22.) Ip, C.; Chin, S.F.; Scimeca, J.A.; Pariza, M.W. Mammary cancer prevention by conjugated dienoic derivative of linoleic acid. Cancer Res. 51:6118-6124; 1991.
23.) Ip, C.; Singh, M.; Thompson, H.J.; Scimeca, J.A. Conjugated linoleic acid suppresses mammary carcinogenesis and proliferative activity of the mammary gland in the rat. Cancer Res. 54:1212-1215; 1994.
24.) Ip, C.; Jiang, C.; Thompson, H.J.; Scimeca, J.A. Retention of conjugated linoleic acid in the mammary gland is associated with tumor inhibition during the post-initiation phase of carcinogenesis. Carcinogenesis 18:755-759; 1997.
25.) Belury, M.A.; Vanden Heuvel, J.P. Protection against cancer and heart disease by the dietary fat, conjugated linoleic acid: potential mechanisms of action (Invited review) Nutr. Dis. Update J. 1:58-63; 1997.
26.) Zu, H.-X.; Schut, H.A.J. Inhibition of 2-amino-3- methylimidazo[4,5-f] quinoline-DNA adduct formation in CDF-1 mice by heat-altered derivatives of linoleic acid. Food Chem. Toxicol. 30:9- 16; 1992.
27.) Liew, C.; Schut, H.A.J.; Chin, S.F.; Pariza, M.W.; Dashwood, R.H. Protection of conjugated linoleic acids against 2-amino-3- methylimidazo[4/5-f] quinoline-induced colon carcinogenensis in the F344 rat – a study of inhibitory mechanisms. Carcinogenesis 16:3037- 3043; 1995.
28.) Ha, Y.L.; Storkson, J.; Pariza, M.W. Inhibition of benzo(a)pyreneinduced mouse forestomach neoplasia by conjugated dienoic derivatives of linoleic acid. Cancer Res. 50:1097-1101; 1990.
29.) Lee, K.N.; Kritchevsky, D.; Pariza, M.W. Conjugated linoleic acid, and atherosclerosis in rabbits. Atherosclerosis 108:19-25; 1994.
30.) Nicolosi, R.J.; Rogers, E.J.; Kritchevsky, D.; Scimeca, J.A.; Huth, P.J. Dietary conjugated linoleic acid reduces plasma lipoproteins and early aortic atherosclerosis in hypersholesterolemic hamsters. Artery 22:266-277; 1997.
31.) Park, Y.; Albright, K.J.; Liu, W.; Storkson, J.M.; Cook, M.E.; Pariza, M.W. Effect of conjugated linoleic acid on body composition in mice. Lipids 32:853-858; 1997.
32.) West, D.B.; Delany, J.P.; Camet, P.M.;Blohm, F.; Truett, A.A.; Scimeca, J. Effects of conjugated linoleic acid on body fat and energy metabolism in the mouse. Am. J. Physiol. 44:R667-R672; 1998.
33.) Cook, M.E.; Jerome, D.L.; Buege, D.R.; Russell, R.L.; Crenshaw, T.C.; Storkson, J.; Albright, K.; Liu, W.; Park, Y.; Pariza, M.W.; Scimeca, J.A.; Lofgren, P.; Hentges, E. Conjugated linoleic acid (CLA) reduces backfat thickness, increases percent lean and improves feed efficiency in pigs. Food Research Institute, Univ. Wisconsin, 1997 Annual Mtg. (poster abstr.); 1997.
34.) Chin, S.F.; Storkson, J.M.; Albright, K.J.; Cook, M.E.; Pariza, M.W. Conjugated linoleic acid is a growth factor for rats as shown by enhanced weight gain and improved feed efficiency. J. Nutr. 124:2344-2349; 1994.
35.) Seifert, M.F.; Watkins, B.A. Role of dietary lipid and antioxidants in bone metabolism. Nutr. Res. 17:1209-1228; 1997.
36.) Li, Y.; Watkins, B.A. Conjugated linoleic acids alter bone fatty acid composition and reduce ex vivo prostaglandin E-2 biosynthesis in rats fed n-6 or n-3 fatty acids. Lipids 33:417-425; 1998.
37.) Houseknecht, K.L.; Vanden Heuvel, J.P.; Moya-Camarena, S.Y.; Portocarrero, C.P.; Peck, L.W.; Nickel, K.P.; Belury, M.A. Dietary Conjugated Linoleic Acid Normalizes Impaired Glucose Tolerance in the Zucker Diabetic Fatty fa/fa Rat. Biochem. Biophys. Res. Commun. 244:678-682; 1998.
38.) Knekt, P.; Jarvinen, R.; Seppanen, R.; Pukkala, E.; Aromaa, A. Intake of dairy products and the risk of breast cancer. Br. J. Cancer 73:687-691; 1996.
39.) Jain, M. Dairy food, dairy fats, and cancer – a review of epidemiological evidence. Nutr. Res. 18:905-937; 1998.
40.) Lavillonniere, F.; Riboli, E.; Martin, J.C.; Lhuillery, C.; Chajes, V.; Bougnoux, P. High conjugated linoleic acids (CLA) content in breast adipose tissue protects against breast cancer. European Section AOCS (abstr); 1998.
41.) Britton, M.; Fong, C.; Wickens, D.; Yudkin, J. Diet as a source of phospholipid esterified 9,11 -octadecadienoic acid in humans. Clin. Sci. 83:97-101; 1992.
42.) Huang, Y.-C.; Luedecke, L.O.; Shultz, T.D. Effect of cheddar cheese consumption on plasma conjugated linoleic acid concentrations in men. Nutr. Res. 14:373-386; 1994.
43.) Park, Y.S.; Behre, R.A.; McGuire, M.A.; Shultz, T.D.; McGuire, M.K. Dietary conjugated linoleic acid (CLA) and CLA in human milk. FASEB J. 11:A239; 1997.
44.) Fogerty, A.C.; Ford, G.L.; Svoronos, D. Octadeca-9,11-dienoic acid in food stuffs and in the lipids of human blood and breast milk. Nutr. Rpt. Int’l. 38:937-944; 1988.
45.) Parodi, P.W. Conjugated linoleic acid: an anticarcinogenic fatty acid present in milk fat. Aust. J. Dairy Technol. 49:93-97; 1994. 46.) Jahreis, G. Anticarcinogenic fatty acids in milk and beef. Ernahrungs. Umschau. 44:168-172; 1997.
47.) Fritsche, J.; Steinhart, H. Amounts of conjugated linoleic acid (CLA) in German foods and evaluation of daily intake. Z. Lebensm. Unters. Forsch A. 206:77-82; 1998.
48.) Agrawal, S.; Heimbach, J.T.; Amann, M.M.; Mohammedshah, F.; Douglas, J.S. Relative intakes of conjugated linoleic acid (CLA) from meat and dairy products as a function of sex and age. J.Am.Col.Nutr. 17(5):526 (abstr. 118); 1998.
49.) Ritzenthaler, K.; McGuire, M.K.; Falen, R.; Shultz, T.D.; McGuire, M.A. Documentation of rumenic acid (RA) intake by 3-day written record, 3-day food duplicate and food frequency questionnaire. Am.J.Clin.Nutr. (In press); 1999.
50.) Pariza, M.W. Conjugated linoleic acid, a newly recognized nutrient. Chem. & Indust. 464-466; 1997.
51) http://www.educacaopublica.rj.gov.br/biblioteca/biologia/bio09d.htm
52) http://www.geocities.com/bioquimicaplicada/Resumo4Aterosclerose.htm
53) http://um-jmh.org/HealthLibrary/meds/Thiazolidinediones.html
Fonte: Baseado em revisão da Associação Nacional dos Produtores de Carne Bovina dos EUA (National Cattlemen’s Beef Association – NCBA)


