1º dia de campo Ponderosa Angus
24 de outubro de 2005Secretário paranaense critica restrição de outros estados
24 de outubro de 2005Ferro, zinco, carne bovina e cognição – Parte 2
Papel do zinco no desenvolvimento e na função cognitiva
a) Deficiência de zinco não é incomum
A deficiência severa de zinco é relativamente rara, mas a deficiência suave deste elemento afeta um segmento substancial da população mundial, incluindo os Estados Unidos (57,58). Apesar de ser difícil de se identificar clinicamente a deficiência suave de zinco e esta depender do histórico dietético da pessoa, ela pode ocorrer até mesmo em populações bem nutridas (59).
O que causa a deficiência de zinco? Processos fisiológicos, com o aumento no crescimento, necessitam de zinco. Desta forma, crianças pequenas, adolescentes e mulheres grávidas podem ter alto risco de apresentar deficiência de zinco (57). A baixa ingestão e a baixa disponibilidade de zinco podem comprometer o status deste elemento (58).
Dados coletados de pesquisas feitas nos EUA, incluindo a Pesquisa Contínua de Ingestão de Alimentos por Indivíduos (Continuing Survey of Food Intakes by Individuals – CSFII), 1994-96, Segunda Pesquisa Nacional de Análise de Saúde e Nutrição (National Health and Nutrition Examination Survey – NHANES II) e a Fase I da Terceira Pesquisa Nacional de Análise de Saúde e Nutrição (National Health and Nutrition Examination Survey – NHANES III) indicam baixas ingestões de zinco em muitos segmentos da população dos EUA (26,27,29,60, Tabela 1).
A ingestão de zinco por mulheres jovens de 18 a 24 anos de idade que participaram da NHANES II era bem abaixo (8,11 mg/dia) da quantidade diária recomendada, de 15 mg por dia de zinco (29). Similarmente, dados da NHANES II indicam que muitos bebês, crianças, mulheres jovens e adultos mais velhos consomem menos zinco do que o recomendado (26,60).
A biodisponibilidade de zinco difere entre os alimentos (58). Em geral, o zinco é mais disponível nos alimentos de origem animal que de origem vegetal (60). Por exemplo, o fitato presente em cereais e legumes limita a biodisponibilidade de zinco (60). As pessoas podem ter risco de ter deficiência suave de zinco como resultado de más escolhas de alimentos, incluindo a baixa ingestão de produtos de origem animal, como carnes vermelhas, que contêm uma alta quantidade de zinco prontamente disponível.
Para adultos mais velhos, as doenças ou os medicamentos que reduzem a biodisponibilidade de zinco ou aumenta sua demanda também representam um risco de uma deficiência marginal de zinco. Além disso, a pobreza e outros fatores socioeconômicos podem afetar as escolhas dos alimentos e comprometer o status de zinco (57).
b) Como o zinco influencia a cognição?
Os mecanismos que ligam o zinco ao desenvolvimento e à função cognitiva não estão claros. Entretanto, o zinco é essencial para a maturação do cérebro e para sua função (57,61). Muitos mecanismos mediados pelo zinco que afetam a função cerebral foram identificados. Certos neurônios do hipocampo são ricos em zinco (62), e cerca de 8 a 10% do zinco dentro dos neurônios são transportados em vesículas e podem ser trocados com outros neurônios.
O estímulo elétrico das fibras musgosas do hipocampo em ratos com deficiência de zinco demonstrou causar um sinal elétrico que difere do sinal dos ratos normais (63). O zinco é liberado no espaço interneuronal durante a transmissão quando pode modular respostas de receptores de neurotransmissores excitatórios e inibitórios (64).
O zinco tem um papel crítico no desenvolvimento do Sistema Nervoso Central (SNC) durante a vida pré e pós natal (61). Enzimas zinco dependentes têm um papel nos processos de replicação de células necessários para o crescimento do cérebro e os neurotransmissores zinco dependentes influenciam a memória (61). Além disso, o zinco está envolvido em processos metabólicos fora do SNC como no transporte de hormônios e na produção de precursores de neurotransmissores que, no final, afetarão o SNC (61).
c) Estudos experimentais com animais associam o zinco à cognição
A essencialidade do zinco para a função neuropsicológica foi primeiramente demonstrada em estudos com animais experimentais, principalmente ratos, resos e macacos. Esses estudos também indicaram mecanismos potenciais pelos quais o zinco afeta o desenvolvimento cognitivo. A deficiência de zinco em animais está associada com mal-formações estruturais no cérebro e com mudanças nas enzimas e proteínas importantes para a neurotransmissão (65).
Problemas comportamentais, como menor atenção, memória e habilidade de aprendizado também foram descritos em animais com deficiência de zinco (21,65-70). Em uma série de estudos com macacos resos, a deficiência de zinco durante os anos pré-natal, início do pós-natal e adolescência/puberdade alteraram o comportamento cognitivo, evidenciado pelo decréscimo na atividade motora e atenção, anormalidades na memória em curto prazo e dificuldades para resolver problemas (68-70). Quando os macacos foram continuamente expostos a ingestões marginalmente baixas de zinco do período fetal à puberdade, a atividade motora e mudanças no comportamento (isto é, vigilância quando avaliados para tarefas contínuas de desempenho) decresceram antes das reduções no crescimento e nos níveis plasmáticos de zinco (70).
Essas descobertas em primatas não humanos (68-70) têm importantes implicações para humanos. Estudos experimentais com animais indicam que a deficiência de zinco pode interferir com a performance cognitiva reduzindo a atividade motora e aumentando a natureza emocional (21).
d) Estudos com humanos associam o zinco à cognição
Poucos estudos avaliaram o papel do zinco na cognição humana. Apesar da relação ainda precise ser claramente estabelecida, pesquisas suportam um papel benéfico do zinco no desenvolvimento e na função cognitiva.
Crianças
Como revisado por Black (21), estudos com bebês e crianças durante os anos pré-escolares indicam que o zinco pode ser importante para o desenvolvimento cognitivo de crianças. Em crianças nascidas com acrodermatite enteropática, uma doença genética rara de severa deficiência de zinco, foram registrados déficits nos desempenhos comportamental e cognitivo (4). O aumento da ingestão de zinco em bebês com baixos pesos ao nascimento e naqueles que vivem em países como Índia e Guatemala foi associado com uma melhora no desenvolvimento motor e na atividade funcional (71,72).
Um estudo envolvendo crianças de seis a nove anos de famílias de baixa renda na China demonstrou que o zinco melhora o desempenho cognitivo uma vez que as deficiências de outros micronutrientes é corrigida (73). Neste experimento controlado, duplo cego, 740 crianças chinesas receberam 20 mg de zinco apenas, 20 mg de zinco com um suplemento de vitaminas, minerais e elementos traço ou um suplemento de micronutrientes apenas, seis vezes por semana, por 10 semanas (73).
O desempenho neuropsicológico, incluindo habilidades motoras finas e grossas e coordenação visual e manual, atenção, percepção visual, memória de curto prazo, formação de conceitos e raciocínio abstrato foi avaliado por uma série de testes. Foi observado um melhor desempenho após o tratamento com zinco e com o suplemento de micronutrientes do que com o suplemento de zinco sozinho. A mudança no desempenho neuropsicológico foi similar para os grupos tratados com suplemento de minerais e zinco (73).
Outros estudos com crianças não mostraram uma associação positiva entre zinco e cognição (74,75). A função cognitiva e a atenção não mudaram nos meninos em idade escolar de Ontário que receberam suplementação de zinco de 10 mg/dia por um ano (74). Da mesma forma, medidas de atenção não sofreram modificações em crianças de seis a sete anos na Guatemala que receberam suplemento de zinco (10 mg/dia) por cerca de três meses (75).
A falha desses estudos com suplemento de zinco em melhorar a cognição das crianças (74,75) pode ser explicada pelas deficiências de outros micronutrientes que limitam a resposta ao zinco ou pela falta de sensibilidade dos testes usados. Além disso, o status de zinco das crianças pode influenciar seu desenvolvimento cognitivo afetando sua emoção, resposta a estresse ambiental e atividade motora (21).
Adultos
Poucos estudos avaliaram o efeito do status de zinco na função cognitiva de adultos. Entretanto, dois estudos pilotos feitos com humanos mostraram que a deficiência suave de zinco prejudicou a performance neuropsicológica de tarefas como memória visual de curto prazo (76,77). Com base em dados experimentais animais, a deficiência materna suave e moderada de zinco pode afetar de forma adversa tanto a função cognitiva da mãe humana como o desenvolvimento de seu bebê (61, Figura 3).
Uma associação positiva foi registrada entre o status materno de zinco durante a gestação e o status de desenvolvimento dos bebês (78,79). A associação foi particularmente forte entre a ingestão de zinco da mãe e o status durante o segundo trimestre da gestação e as medidas neonatais de atenção e processamento de informações, ambos refletindo a habilidade cognitiva (79). Essas descobertas, juntamente com dados de primatas não-humanos, indicam que o status materno de zinco durante a gestação pode ser especialmente importante para o desenvolvimento do SNC do bebê e de sua função cognitiva mais para frente em sua vida.

Existem poucas informações disponíveis sobre o papel do zinco na função cognitiva de adultos mais velhos. Entretanto, foi registrada uma associação positiva entre ingestão dietética de zinco e função cognitiva em adultos com idade de 65 a 90 anos na Espanha (3).
No início dos anos oitenta, Burnet (80) levantou a hipótese de que a deficiência de zinco pode estar associada com demência senil do tipo Alzheimer devido ao envolvimento de várias enzimas dependentes de zinco no metabolismo neuronal. Outros pesquisadores relacionaram os níveis plasmáticos de zinco um ano antes da morte com a intensidade das placas no cérebro das pessoas após a morte (81). Metabolismo prejudicado de zinco, especificamente os baixos níveis de plasma e timulina (um peptídeo transportador de zinco) foi encontrado em pacientes com demência senil do tipo Alzheimer (82).
A descoberta de níveis reduzidos de zinco no sangue e em tecidos cerebrais de pacientes com doença de Alzheimer levou à sugestão de que o zinco pode ter um papel no processamento da memória (83). Um estudo preliminar envolvendo seis pacientes com esta doença mostrou que 15 mg de zinco por via oral na forma de zinco quelado com metionina duas vezes ao dia por um ano corrigiram a microviscosidade da membrana plaquetária em seus pacientes e melhoraram modestamente a cognição em quatro pacientes como pôde ser medido nos testes psicométricos (83). Essas descobertas, embora sugestivas, suportam a necessidade de mais pesquisas sobre o papel do zinco na doença de Alzheimer.
A carne bovina pode melhorar o desempenho cognitivo?
A carne bovina é uma importante fonte de ferro e zinco biodisponível da dieta. Considerando o papel potencialmente benéfico desses nutrientes no desenvolvimento e na função cognitiva, a ingestão de carnes vermelhas, como carne bovina, pode melhorar a cognição, particularmente em pessoas com ou em risco de deficiência.
Estudos preliminares em macacos resus adolescentes mostraram que a carne bovina da dieta não somente corrige os efeitos hematológicos de uma dieta deficiente em ferro e zinco, mas também, alivia alguns dos déficits comportamentais associados com esta dieta (84,85).
O aumento do ferro e do zinco na forma de carne bovina compensou os déficits nas funções do SNC de animais e melhorou significantemente a porcentagem de resultados corretos em tarefas prolongadas de atenção (85). Quase todas as pesquisas sobre o papel do ferro e do zinco na cognição usam suplementos ao invés de fontes alimentícias desses nutrientes. São necessárias consideravelmente mais pesquisas usando alimentos como fontes desses nutrientes, como carnes vermelhas, carne bovina em particular, para determinar como esses alimentos beneficiam a cognição.
Suprindo as necessidades de ferro e zinco
Os alimentos do Grupo de Carnes (particularmente as carnes vermelhas) são as principais fontes de ferro e zinco biodisponíveis da dieta (86). De acordo com dados de 1994, os alimentos deste Grupo contribuem com 16,3% do ferro e com 41,5% do zinco disponível nos alimentos dos EUA (86, figuras 4 e 5). Somente as carnes vermelhas contribuem com 10,6% do ferro e com 30,4% do zinco disponível para consumo.
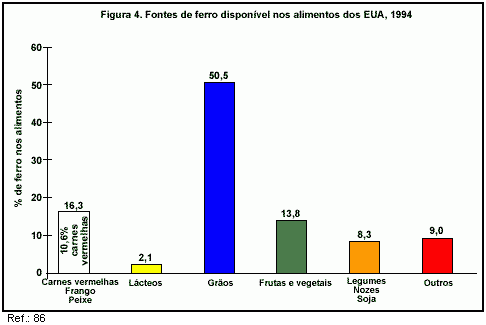
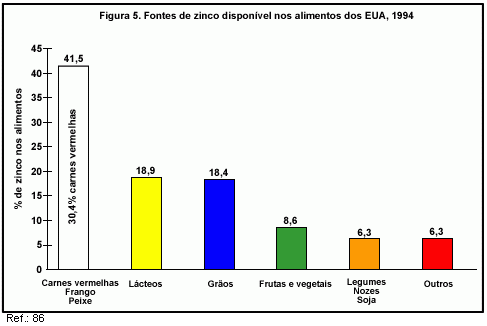
Em termos de ingestão real, uma pesquisa feita nos EUA com mais de 4,7 mil pessoas mostrou que o Grupo de Carnes fornece 3,4 mg de ferro por dia e 5,3 mg de zinco por dia (87, figura 6).
Devido ao seu alto teor de ferro e zinco, juntamente com o consumo freqüente, a carne bovina fornece quase 58% do ferro e 68% do zinco de todas as carnes (87, figura 6). A carne bovina é a principal fonte de ferro e zinco para as crianças e adolescentes dos EUA com idade de dois a 18 anos e para adultos, de acordo com uma análise das principais fontes de alimentos de nutrientes e constituintes da dieta (88,89).
Tanto para crianças como para adultos, a carne bovina foi a terceira fonte de ferro e a principal fonte de zinco em suas dietas (88,89). Quase 8% do ferro ingerido pelas crianças e adolescentes de dois a 18 anos de idade, 6% do ferro ingerido por crianças de dois a cinco anos de idade e 9,4% do ferro ingerido por adultos foram fornecidos pela carne bovina (88,89). A carne bovina fornece 22% do zinco total consumido por crianças e adolescentes de dois a 18 anos de idade, 17% do zinco ingerido por crianças de dois a cinco anos de idade de 25,7% do zinco ingerido por adultos (88,89). Outros alimentos do Grupo de Carnes, como carne de aves, bem como alimentos como grãos desidratados têm uma contribuição consideravelmente menor na ingestão de ferro e zinco do que a carne bovina (88,89).
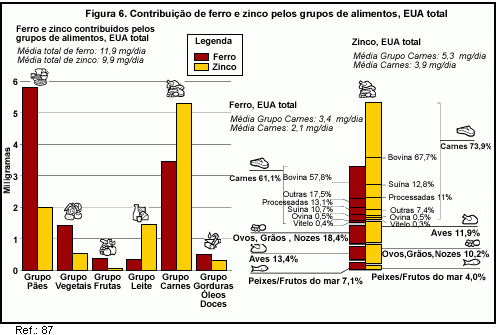
As carnes vermelhas, como a carne bovina, são fontes de ferro e zinco prontamente disponíveis. Devido à fortificação ou enriquecimento com ferro, alimentos do Grupo de Grãos ou Pães contribuem com mais ferro do que os alimentos do Grupo de carnes (figuras 4 e 6). Entretanto, os alimentos do Grupo de Carnes contêm ferro heme que é mais prontamente absorvido do que o ferro não heme presente em grãos, frutas, vegetais, ovos e alimentos lácteos. O ferro heme é cerca de duas a três vezes mais absorvível do que o ferro não heme (23). A biodisponibilidade do ferro não heme é fortemente afetada por outros alimentos consumidos na mesma refeição (23,90).
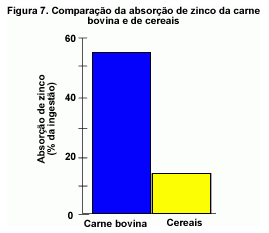
O zinco também é prontamente disponível a partir de carnes vermelhas, como a carne bovina (91,92). A biodisponibilidade do zinco da carne bovina é cerca de quatro vezes maior do que a do zinco presente em cereais ricos em fibras consumidos no café da manhã por adultos saudáveis (93, figura 7).
Similarmente, um estudo com bebês mostrou que a absorção fracionária do zinco foi maior a partir da carne bovina do que de cereais (94). Alimentos típicos para bebês desmamados nos EUA são fontes pobres de ferro e zinco. A introdução de carnes vermelhas como um dos primeiros alimentos do bebê beneficia seu crescimento e fornece quantidades adequadas de ferro e zinco biodisponíveis para suprir as necessidades do bebê por esses nutrientes, de acordo com um estudo longitudinal de um ano (95). Este estudo comparou o crescimento em 19 bebês que receberam aleitamento materno que foram alimentados ou com carne bovina ou com cereal de arroz fortificado com ferro como alimentos iniciais após o desmame.
A ingestão adequada de ferro e zinco na dieta é particularmente importante durante o período de desmame quando os estoques hepáticos desses nutrientes do bebê são frequentemente esgotados e a ingestão de cereais, a partir dos quais esses nutrientes são pobremente disponíveis, é aumentada. No estudo, observou-se que houve uma grande aceitabilidade da carne bovina como um alimento inicial após o desmame, tanto por bebês como pelas mães (95). Isso contrastou com a crença existente de que os cereais devem sempre ser introduzidos primeiro.
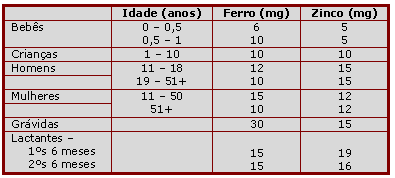
As quantidades diárias recomendadas de ferro e zinco variam entre as faixas etárias como apresentado na Tabela 1 (28). Boas fontes desses nutrientes incluem alimentos do Grupo de Carnes, especialmente carnes vermelhas, como carne bovina (96). Em muitos casos, carnes ricas em zinco também são ricas em ferro. Com exceção dos suplementos de ferro para mulheres grávidas, os alimentos são considerados as melhores fontes de nutrientes como ferro e zinco (97).
Tabela 1. Quantidades dietéticas recomendadas de ferro e zinco, 1989 (28)
Conclusões
Várias evidências de experimentos com animais e humanos indicam que o ferro e o zinco têm importantes papéis na cognição. Ingestões adequadas durante os primeiros anos de vida são importantes para o desenvolvimento cerebral e sua função. Apesar de limitados, os dados de adultos indicam que o ferro e o zinco também são importantes para a cognição nesta faixa etária.
A maioria das pesquisas que avalia os efeitos do ferro e do zinco na cognição tem usado suplementos para demonstrar o papel essencial desses nutrientes. Esses dados podem ser traduzidos em ingestões de alimentos que são fontes desses nutrientes. No entanto, os efeitos da biodisponibilidade têm sido muitas vezes ignorados. As carnes vermelhas são as melhores fontes de ferro e zinco da dieta. A biodisponibilidade desses nutrientes nas carnes vermelhas, como carne bovina, é maior do que nos alimentos de origem vegetal, como grãos, frutas e vegetais.
O consumo de pelo menos duas a três porções (140 s 200 gramas) de carne magra cozida por dia, incluindo carnes vermelhas, como parte de uma dieta nutricionalmente balanceada contendo uma variedade de alimentos, é importante para ajudar a suprir as necessidades de ferro e zinco, obter saúde de forma geral e potencialmente beneficiar o desenvolvimento e a função cognitiva.
Referências bibliográficas
1. Kretchmer N, Beard JL, Carlson S. The role of nutrition in the development of normal cognition. Am J Clin Nutr. 1996; 63: 997s-1001s.
2. Pollitt E. Poverty and child development: relevance of research in developing countries to the United States. Child Develop. 1994; 65(2): 283-295.
3. Ortega RM, Requejo AM, Andres P, Lopez-Sobalec, AM, Quintas ME, Redondo MR, Navia B, Rivas T. Dietary intake and cognitive function in a group of elderly people. Am J Clin Nutr. 1997; 66: 803-809.
4. Kanarek RB, Marks-Kaufman R. Nutrition and Behavior. 1991. New York: Van Nostrand Reinhold.
5. Wachs TD. Relation of mild-to-moderate malnutrition to human development: correlational studies. J Nutr. 1995: 125: 2245s-2254s.
6. Pollitt E, Watkins WE, Husaini MA. Three-month nutritional supplementation in Indonesian infants and toddlers benefits memory function 8 y later. Am J Clin Nutr. 1997; 66: 1357-1363.
7. LaRue A, Koehler KM, Wayne SJ, Chiulli SJ, Hoaland KY, Garry PJ. Nutritional status and cognitive functioning in a normally aging sample: a 6-y reassessment. Am J Clin Nutr. 1997; 65: 20-29.
8. Pollitt, E., Lewis NS, Garza C, Shulman R. Fasting and cognitive function. J Psychiatr Res. 1982/83; 17: 169-174.
9. Allen, LH. Functional indicators and outcomes of undernutrition. J Nutr. 1990; 120: 924-932.
10. Meyers AF, Sampson AE, Weitzman M, Rogers BL, Kayne H. School breakfast programs and school performance. 1989; 143: 1234-1239.
11. Meyers AF, Sampson AE, Weitzman M. Nutrition and academic performance in school children. Clin Appl Nutr. 1991; 1: 13-25.
12. Simeon DT, Grantham-McGregor S. Effects of missing breakfast on the cognitive functions of school children of differing nutritional status. Am J Clin Nutr. 1989; 49: 646-653.
13. Simeon DT, Grantham-McGregor SM. Nutritional deficiencies and children’s behavior and mental development. Nutr Res Rev. 1990; 3: 1-24.
14. Center on Hunger, Poverty and Nutrition Policy, Tufts University School of Nutrition. Statement on the Link between Nutrition and Cognitive Development in Children. 1995. Medford, MA: Tufts University.
15. Kleinman RE, Murphy M, Little M, Pagano M, Wehler CA, Regal K, Jellinek MS. Hunger in children in the United States: potential behavioral and emotional correlates. Pediatrics 1998; 101: 1-6.
16. Pollitt E. Does breakfast make a difference in school? J Am Diet Assoc. 1995; 95: 1134-1139.
17. Murphy JM, Pagano ME, Nachmani J, Sperling P, Kane S, Kleinman RE. The relationship of school breakfast to psychosocial and academic functioning. Arch Pediatr Adol Med. 1998; 152: 899- 907.
18. Allen LH. The Nutritional CRSP: what is marginal malnutrition, and does it affect human function? Nutr. Rev. 1993; 51: 255-267.
19. Pollitt E. Functional significance of the covariance between protein energy malnutrition and iron deficiency anemia. J Nutr. 1995; 125: 2272s-2277s.
20. Pollitt E. Iron deficiency and educational deficiency. Nutr Rev. 1997; 55: 133-141.
21. Black MM. Zinc deficiency and child development. Am J Clin Nutr. 1998; 68: 464s-469s.
22. Viteri FE. Iron supplementation for the control of iron deficiency in populations at risk. Nutr. Rev. 1997; 55: 195-209.
23. CDC, U.S. Department of Health and Human Services. Recommendations to prevent and control iron deficiency in the United States. MMWR 1998; 46(No.RR-3): 1-29.
24. Looker AC, Dallman PR, Carroll, MD, Gunter EW, Johnson CL. Prevalence of iron deficiency in the United States. JAMA 1997; 277: 973-976.
25. Hallberg L, Rossander-Hulten L. Iron requirements in menstruating women. Am J Clin Nutr. 1991; 54: 1047- 1058.
26. Alaimo K, McDowell MA, Briefel RR et al. Dietary intake of vitamins, minerals, and fiber of persons ages 2 months and over in the United States: Third National Health and Nutrition Examination Survey, Phase 1, 1988-91. Hyattsville, Maryland: National Center for Health Statistics; 1994. Advance Data from Vital and Health Statistics; No. 258.
27. U.S. Department of Agriculture, Agricultural Research Service. 1997. Data tables: Results from USDA’s 1994- 96 Continuing Survey of Food Intakes by Individuals and 1994-96 Diet and Health Knowledge Survey, ARS Food Surveys Research Group. December
1997. Available (under “Releases”): http://www.barc.usda.gov/bhnrc/foodsurvey/home.htm
28. National Research Council, Subcommittee on the Tenth Edition of the RDAs, Food and Nutrition Board, Commission on Life Sciences, Recommended Dietary Allowances. 10th ed. 1989. Washington DC: National Academy Press.
29. Murphy SP, Calloway DH. Nutrient intakes of women in NHANES II, emphasizing trace minerals, fiber, and phytate. J Am Diet Assoc. 1986; 86: 1366-1372.
30. Pollitt E. Iron deficiency and cognitive function. Annu Rev Nutr. 1993; 13: 521-537.
31. Abbott R. The effects of iron supplementation on cognitive function in infants and children. In: Sandstrom B, Walter P (eds). Role of Trace Elements for Health Promotion and Disease Prevention. Bibl Nutr Dieta. Basel, Karger, 1998; No. 54: 67-75.
32. Holst M-C. Developmental and behavioral effects of iron deficiency anemia in infants. Nutrition Today 1998; 33: 27-36.
33. Weinberg J, Dallman P, Levine S. Iron deficiency during early development in the rat: behavioral and physiological consequences. Pharmacol Biochem Behav. 1980; 12: 493-502.
34. Weinberg J, Brett L, Levine S, Dallman P. Long-term effects of iron deficiency on consummatory behavior in the rat. Pharmacol Biochem Behav. 1981; 14: 447-453.
35. Yehuda S, Youdim M, Mostofsky D. Brain iron-deficiency causes reduced learning capacity in rats. Pharmacol Biochem Behav. 1986; 25: 141-144.
36. Dallman PR. Biochemical basis for the manifestation of iron deficiency. Annu Rev Nutr. 1986; 6: 13-40.
37. Idjradinata P, Pollitt E. Reversal of developmental delays in iron-deficient anaemic infants treated with iron. Lancet 1993; 341: 1-4.
38. Walter T. Impact of iron deficiency on cognition in infancy and childhood. Europ J Clin Nutr. 1993; 47: 307-316.
39. Lozoff B, Brittenham GM, Wolf AW. Iron deficiency anaemia and iron therapy: effects on infant test performance. Pediatrics 1987; 79: 981-995.
40. Lozoff B, Jimenez E, Wolf AW. Long-term developmental outcome of infants with iron deficiency. N Engl J Med. 1991; 325: 687-694.
41. Lozoff B, Wolf AW, Jimenez E. Iron deficiency anemia and infant development: effects of extended oral iron therapy. J Pediatr. 1996; 129: 382-389.
42. Lozoff B, Wolf A, Mollen E, et al. Functional significance of early iron deficiency. Pediatr Res. 1997; 41: 15A.
43. Halberg L. Search for nutritional confounding factors in the relationship between iron deficiency and brain function. Am J Clin Nutr. 1989; 50: 598-606.
44. Pollitt E. Timing and vulnerability in research on malnutrition and cognition. Nutr Rev. 1996; 54: 49s- 55s.
45. Beard J. One person’s view of iron deficiency, development, and cognitive function. Am J Clin Nutr. 1995; 62: 709-710.
46. Strupp BJ, Levitsky DA. Enduring cognitive effects of early malnutrition: a theoretical reappraisal. J Nutr. 1995; 125: 2221s-2232s.
47. Corrigan N, Stewart M, Scott M, Fee F. Fragile X, iron, and neurodevelopmental screening in 8 year old children with mild to moderate learning difficulties. Arch Dis Child. 1997; 76: 264-267.
48. Soemantri AG. Preliminary findings on iron supplementation and learning achievement of rural Indonesian children. Am J Clin Nutr. 1989; 50: 698-702.
49. Soewondo S. The effect of iron deficiency and mental stimulation on Indonesian children’s cognitive performance and development. Kobe J Med Sci. 1995; 41: 1- 17.
50. Pollitt E, Hathirat P, Kotchabhakdi NJ, Missell L, Valyasevi A. Iron deficiency and educational achievement in Thailand. Am J Clin Nutr. 1989; 50: 687-697.
51. Seshadri S, Gopaldas T. Impact of iron supplementation on cognitive functions in preschool and school-aged children: the Indian experience. Am J Clin Nutr. 1989; 50: 675-686.
52. Bruner AB, Joffe A, Duggan AK, Casella JF, Brandt J. Randomised study of cognitive effects of iron supplementation in non-anaemic iron-deficient adolescent girls. Lancet 1996; 348: 992-996.
53. Tucker DM, Sandstead HH, Penland JG, Dawson SL, Milne DB. Iron status and brain function: serum ferritin levels associated with asymmetries of cortical electrophysiology and cognitive performance. Am J Clin Nutr. 1984; 39: 105-113.
54. Kretsch MJ, Fong AKH, Green MW, Johnson HL. Cognitive function, iron status, and hemoglobin concentration in obese dieting women. Europ J Clin Nutr. 1998; 52: 512-518.
55. Tucker DM, Penland JG, Sandstead HH, Milne DB, Heck DG, Klevay LM. Nutrition status and brain function in aging. Am J Clin Nutr. 1990; 52: 93-102.
56. Hallberg L. Search for nutritional confounding factors in the relationship between iron deficiency and brain function. Am J Clin Nutr. 1989; 50: 598-606.
57. Sandstead HH. Zinc deficiency: a public health problem? Am J Dis Child. 1996; 145: 853-859.
58. Prasad AS. Zinc: an overview. Nutrition 1995; 11: 93s- 99s.
59. Skinner JD, Carruth BR, Houck KS, et. al. Longitudinal study of nutrient and food intakes of infants aged 2 to 24 months. J Am Diet Assoc. 1997; 97: 496-504.
60. Sandstead HH, Smith JC Jr. Deliberations and evaluations of approaches, endpoints and paradigms for determining zinc dietary recommendations. J Nutr. 1996; 126: 2410s-2418s.
61. Caulfield LE, Zavaleta N, Shankar AH, Merialdi M. Potential contribution of maternal zinc supplementation during pregnancy to maternal and child survival. Am J Clin Nutr. 1998; 68: 499s-508s.
62. Frederickson C, Danscher G. Zinc-containing neurons in hippocampus and related CNS structure. Prog Brain Res. 1990; 83: 71-84.
63. Hesse G. Chronic zinc deficiency alters neuronal function of hippocampal mossy fibers. Science 1979; 205: 1005-1007.
64. Cuajungco MP, Lees GJ. Zinc metabolism in the brain: relevance to human neuro-degenerative disorders. Neurobiol Dis. 1997; 4: 137-169.
65. Golub MS, Keen CL, Gershwin ME, Hendrickx AG. Developmental zinc deficiency and behavior. J Nutr. 1995; 125: 2263s-2271s.
66. Halas ES, Eberhardt MJ, Diers MA, Sandstead SS. Learning and memory impairment in adult rats due to severe zinc deficiency during lactation. Physiol Behav. 1983; 30: 371-381.
67. Sandstead HH, Strobel DA, Logan GM, Marks EO, Jacob RA. Zinc deficiency in pregnant rhesus monkeys: effects on behavior of infants. Am J Clin Nutr. 1996; 31: 844-849.
68. Golub MS, Gershwin ME, Hurley LS, Hendrickx AG, Saito WY. Studies of marginal zinc deprivation in rhesus monkeys: infant behavior. Am J Clin Nutr. 1985; 42: 1229-1239.
69. Golub MS, Takeuchi PT, Keen CL, Gershwin ME, Hendrickx AG, Lonnerdal B. Modulation of behavioral performance of prepubertal monkeys by moderate dietary zinc deprivation. Am J Clin Nutr. 1994; 60: 238- 243.
70. Golub MS, Takeuchi PT, Keen CL, Hendrickx AG, Gershwin ME. Activity and attention in zinc-deprived adolescent monkeys. Am J Clin Nutr. 1996; 64: 908- 915.
71. Sazawal S, Bentley M, Black RE, Dhingra P, George S, Bhan MK. Effect of zinc supplementation on observed activity in preschool children in an urban slum population. Pediatrics 1996; 98: 1132-1137.
72. Bentley ME, Caulfield LE, Ram M., et. al. Zinc supplementation affects the activity patterns of rural Guatemalan infants. J Nutr. 1997; 127: 1333-1338.
73. Sandstead HH, Penland JG, Alcock NW, Dayal HH, Chen XC, Li JS, Zhao F, Yang JJ. Effects of repletion with zinc and other micronutrients on neuropsychologic performance and growth of Chinese children. Am J Clin Nutr. 1998; 68: 470s-475s.
74. Gibson RS, Vanderkooy PDS, MacDonald AC, Goldman A, Ryan BA, Berry M. A growth-limiting mild zinc deficiency syndrome in some Southern Ontario boys with low height percentiles. Am J Clin Nutr. 1989; 49: 1266-1273.
75. Cavan KR, Gibson RS, Grazioso CF, Isalque AM, Ruz M, Solomons N. Growth and body composition of periurban Guatemalan children in relation to zinc status: a longitudinal zinc intervention trial. Am J Clin Nutr. 1993; 57: 344-352.
76. Penland JG. Cognitive performance effects of low zinc (Zn) intakes in healthy adult men. FASEB J. 1991; 5: A938.
77. Darnell LS, Sandstead HH. Iron, zinc, and cognition of women. Am J Clin Nutr. 1991; 53: P-16.
78. Kirksey A, Rahmanifar A, Wachs TD, et al. Determinants of pregnancy outcome and newborn behavior of a semirural Egyptian population. Am J Clin Nutr. 1991; 54: 657-667.
79. Kirksey A, Wachs TD, Yunis F, et al. Relation of maternal zinc nutriture to pregnancy outcome and infant development in an Egyptian village. Am J Clin Nutr. 1994; 60: 782-92.
80. Burnet FM. A possible role of zinc in the pathology of dementia. Lancet 1981; 1: 186-188.
81. Tulley C, Snowdon D, Markesbery W. Serum zinc, senile plaques, and neurofibrillary tangles: findings from the Nun Study. Neuroreport 1995; 6: 2105-2108.
82. Licastro F, Davis LJ, Mocchegiani E, Fabris N. Impaired peripheral zinc metabolism in patients with senile dementia of probable Alzheimer’s Type as shown by low plasma concentrations of thymulin. Biol. Trace Element Research 1996; 51: 55-62.
83. Potocnik FCV, Van Rensburg SJ, Park C, Taljaard JJF, Emsley RA. Zinc and platelet membrane microviscosity in Alzheimer’s disease. S Afr Med J. 1997; 87: 1116- 1119.
84. Keen CL, Golub MS. Hematology parameters in female adolescent monkeys: effect of iron-zinc deficiency and a beef protein supplement. FASEB J. 1998; 12(4): A219 (1280).
85. Golub MS, Keen CL. Performance of an attention task by iron-zinc deficient adolescent monkeys and the influence of a beef protein supplement. FASEB J. 1998; 12(4): A236 (1377).
86. Gerrior S, Bente L. Nutrient content of the U.S. Food Supply, 1909-94. Home Economics Research Report No. 53. 1997. U.S. Department of Agriculture, Center for Nutrition Policy and Promotion.
87. National Live Stock and Meat Board. Eating in America Today. A Dietary Pattern and Intake Report Commissioned by the National Live Stock and Meat Board. Edition II. Chicago, IL: National Live Stock and Meat Board, 1994.
88. Subar AF, Krebs-Smith SM, Cook A, Kahle LL. Dietary sources of nutrients among US children, 1989-1991. Pediatrics 1998; 102: 913-923.
89. Subar AF, Krebs-Smith SM, Cook A, Kahle LL. Dietary sources of nutrients among US adults, 1989 to 1991. J Am Diet Assoc. 1998; 98: 537-547.
90. National Cattlemen’s Beef Association. Iron In Human Nutrition. 2nd ed. 1999. Chicago, IL: National Cattlemen’s Beef Association.
91. National Cattlemen’s Beef Association. Zinc In Human Nutrition. 2nd ed. 1997. Chicago, IL: National Cattlemen’s Beef Association.
92. Johnson JM, Walker PM. Zinc and iron utilization in young women consuming a beef-based diet. J Am Diet Assoc. 1992; 92: 1474-1478.
93. Zheng JJ, Mason JB, Rosenberg IH, et al. Measurement of zinc bioavailability from beef and a ready-to-eat highfiber breakfast cereal in humans: application of a whole-gut lavage technique. Am J Clin Nutr. 1993; 58: 902-907.
94. Jalla S, Steirn ME, Miller LV, Krebs NF. Comparison of zinc absorption from beef vs iron fortified rice cereal in breast-fed infants. FASEB J. 1998; 12(4): A346 (2010).
95. Westcott JL, Simon NB, Krebs NF. Growth, zinc and iron status, and development of exclusively breast-fed infants fed meat vs cereal as a first weaning food. FASEB J. 1998; 12(5): A 848 (4910).
96. U.S. Department of Agriculture, Agricultural Research Service. USDA Nutrient Database for Standard Reference, Release 12. Nutrient Data Laboratory, 1998. Home Page: http://www.nal.usda.gov/fnic/foodcomp.
97. U.S. Department of Agriculture, U.S. Department of Health and Human Services. Nutrition and Your Health: Dietary Guidelines for Americans. Fourth Edition. December 1995.
98. U.S. Department of Agriculture. The Food Guide Pyramid. Home and Garden Bulletin No. 252. 1992. Hyattsville, MD: USDA, Human Nutrition Information Service.
99. Center for Nutrition Policy and Promotion, US Department of Agriculture. The Healthy Eating Index. Washington DC: Office of Communications, 1995.
100. Coordenação-Geral da Política de Alimentação e Nutrição, Ministério da Saúde (http://dtr2004.saude.gov.br/nutricao/deficiencia_ferro.php).
101. http://www.bbc.co.uk/portuguese/ciencia/story/2004/01/040122_vitaminspc.shtml


