Indústria de carne bovina da Austrália revisa estratégias de marketing
16 de abril de 2004A epidemia de BSE
16 de abril de 2004Nutrientes da carne bovina e cognição
A cognição, ou nossa capacidade de perceber, pensar e lembrar, é influenciada por muitos fatores, sendo um deles a nutrição (1). Uma dieta carente em proteína-energia, ou seja, uma síndrome de múltiplas deficiências nutricionais, está associada com uma série de déficits cognitivos e comportamentais. Entre crianças, a carência de proteína-energia gera impactos no desenvolvimento mental e na cognição. Esta também reduz a interação das crianças com o ambiente o que pode levar a problemas com a atenção, inatividade e insensibilidade. Cada um destes comportamentos pode comprometer a capacidade de aprendizagem da criança. Entre os adultos, a subnutrição pode levar a déficits cognitivos e reduzir a capacidade de agir de forma independente (2). Mesmo uma carência nutricional de curto prazo, como passar fome ou pular uma refeição pode afetar negativamente o desenvolvimento cognitivo e a performance (3).
Deficiências de nutrientes específicos, como ferro e zinco, podem estar envolvidas em muitos dos mesmos efeitos descritos para a carência proteína-energia. Um prejuízo da função cognitiva é um dos muitos potenciais resultados de uma deficiência de ferro e zinco (4,5). Desta forma, é de particular interesse detectar se a ingestão de carnes vermelhas, como a carne bovina, que são as principais fontes de ferro e zinco prontamente biodisponíveis, afeta a cognição (6).
Quando se avaliam estudos sobre nutrição e cognição, é importante notar as dificuldades na comparação dos resultados obtidos nestes estudos, derivadas das diferenças nos testes usados para medir funções cognitivas específicas, da escolha do critério diagnóstico usado para definir o status nutricional, e dos potenciais fatores que podem gerar confusão, como deficiências de outros nutrientes e fatores sócio-econômicos.
Papel do ferro na cognição
As descobertas de estudos experimentais com animais e com humanos fornecem evidências do papel no ferro na função cognitiva. Em animais de laboratório, a anemia por deficiência de ferro reduziu a quantidade de ferro em áreas específicas do cérebro, prejudicando a mielinização de células nervosas e a produção de neurotransmissores, especialmente dopamina (4,6-8). Estas mudanças podem levar a alterações na maturação e na função de uma série de aspectos do sistema nervoso central envolvidos em comportamentos específicos. A deficiência de ferro em animais experimentais pode também afetar o comportamento cognitivo reduzindo a atenção e a resposta do animal a estímulos ambientais. Isso poderia levar a menos experiências de aprendizado e a uma menor habilidade de se obter informações (6). Por outro lado, a anemia por deficiência de ferro pode afetar o desenvolvimento motor e, com isso, a performance em tarefas comportamentais específicas (8).
Estudos com humanos indicam que a adequada ingestão de ferro, da infância até a vida adulta, é importante para se atingir o potencial cognitivo. A maioria das pesquisas nesta área envolve bebês, crianças em idade pré-escolar e crianças em idade escolar (4). Bebês e crianças de um a três anos com deficiência de ferro geralmente apresentam uma performance ruim em testes de desenvolvimento motor e mental. Elas também são descritas como retraídas, cautelosas, desatentas e letárgicas (sem energia), o que poderia interferir em sua capacidade de interagir com o ambiente e comprometer seu desenvolvimento intelectual (9). Estudos com suplementação de ferro em crianças de um a três anos com deficiência deste elemento deram um suporte adicional para esta ligação causal entre a deficiência de ferro e o desenvolvimento cognitivo no início do desenvolvimento (10).
Apesar de alguns estudos sugerirem que a deficiência de ferro nos primeiros anos de vida pode ter efeitos cognitivos permanentes e irreversíveis (11,12), este assunto ainda é bastante controverso. O tempo, a severidade e/ou a constância da deficiência de ferro, bem como outros fatores que podem confundir, podem influenciar os efeitos da deficiência de ferro na cognição (8).
Entre as crianças em idade pré-escolar e escolar, a anemia por deficiência de ferro está associada a uma performance prejudicada em testes de QI e testes de realização escolar (4). Um estudo em crianças egípcias de 8 a 11 anos de idade mostrou que aquelas com anemia por deficiência de ferro cometiam mais erros e eram menos eficientes no “Teste de Combinação de Figuras Familiares” do que as crianças não anêmicas (13). Além disso, o tratamento com 50 mg de sulfato de ferro oral (2 mg de ferro elementar) reduz erros e melhora os escores de eficiência (13).
Similarmente, entre adolescentes, a anemia por deficiência de ferro está associada com uma performance acadêmica prejudicada e a suplementação com ferro melhora os escores nos testes relacionados com componentes específicos de cognição (6). Um teste feito com placebo envolvendo 73 meninas adolescentes com deficiência suave de ferro mostrou que a suplementação com sulfato de ferro oral (650 mg duas vezes ao dia ou 260 mg de ferro elementar), por oito semanas, melhorou a aprendizagem verbal e a memória, ambas importantes para a performance acadêmica (14).
Estão disponíveis relativamente menos informações sobre os efeitos cognitivos da deficiência de ferro em adultos, particularmente em pessoas mais velhas (7). Entretanto, existem algumas evidências de que a deficiência de ferro em adultos mais velhos está associada com alterações sutis no eletroencefalograma, indicando mudanças neuropatológicas em cérebros mais velhos, com baixa performance em testes selecionados da função cognitiva (2,15).
Papel do zinco na cognição
Estudos experimentais com animais sugerem um papel biológico do zinco no desenvolvimento do sistema nervoso central e da função cognitiva. Além disso, foram descritos problemas comportamentais em animais com deficiência de zinco (16,17). Em uma série de estudos com macacos reso, a deficiência de zinco durante os anos pré-natal, início do pós-natal e adolescência/puberdade alterou o comportamento cognitivo, evidenciado pelo decréscimo da atividade motora e atenção, anormalidades na memória de curto prazo e dificuldades na resolução de problemas (6,16,17).
Comparado com o ferro, foram feitos relativamente menos estudos avaliando o papel do zinco na performance cognitiva de humanos. No entanto, pesquisas emergentes apóiam o papel benéfico do zinco no desenvolvimento e na função cognitivos (7,18). Como revisado por Penland (18), desenvolvimento motor, atenção, responsividade e atividade foram melhoradas em crianças com deficiência de zinco que receberam suplemento de 10 mg de zinco por dia.
Entre as crianças em idade escolar, tem sido demonstrado que uma maior ingestão de zinco melhora a performance cognitiva, pelo menos quando as deficiências de outros micronutrientes foram corrigidas (5, 18, 19). Em um experimento controlado e aleatório de 10 semanas envolvendo 740 crianças urbanas e 540 crianças rurais da China de idade entre seis e nove anos, a memória de reconhecimento, o raciocínio, a função psicocomotora e a atenção melhoraram mais em crianças que receberam uma mistura de micronutrientes incluindo 20 mg de zinco por dia do que naquelas alimentadas apenas com uma mistura de micronutrientes (5). Um efeito benéfico do zinco e de uma mistura de micronutrientes na cognição também foi demonstrado em um estudo com 240 crianças mexicano-americanas de baixa renda de idade entre seis e nove anos com risco de deficiência de zinco por causa de suas dietas ricas em fitato (18,19). As crianças foram divididas em quatro grupos que receberam (a) uma mistura de micronutrientes; (b) uma mistura de micronutrientes mais 20 mg de zinco por dia; (c) um mistura de micronutrientes mais 24 mg de ferro por dia; e (d) placebo, durante cinco dias por semana, por 10 semanas. As funções cognitivas e psicomotoras (isto é, atenção, percepção, memória, raciocínio, habilidades motoras e espaciais) foram determinadas antes e depois do tratamento. As medidas pós-tratamento foram expressas como uma porcentagem das medidas pré-tratamentos para análises. Melhoras significantemente maiores no raciocínio (isto é, menos testes para aprender simples conceitos) foram encontradas no grupo que recebeu a mistura de micronutrientes adicionada de zinco, comparadas com os outros tratamentos ou o placebo (Figura 1).
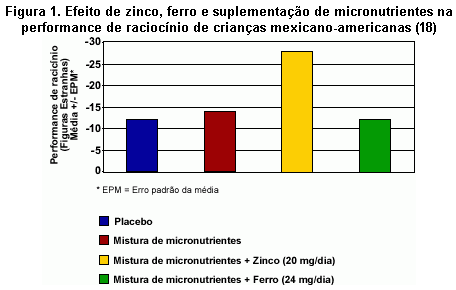
Como revisado por Penland (19), existem poucos estudos experimentais sobre a ingestão de zinco ou o status de zinco e o comportamento em adultos. Dois estudos pilotos indicam que deficiências suaves de zinco prejudicam a performance nas tarefas cognitivas como memória visual de curto prazo. Em mulheres com deficiência de ferro, a adição de zinco (30 mg por dia) e ferro, sozinhos ou juntos, ao suplemento de vitaminas e minerais melhorou a memória visual de curto prazo, enquanto que somente o suplemento não teve este efeito (20). Em homens adultos, uma deficiência suave de zinco causada por ingestão de dietas pobres em zinco por 35 dias resultou em anormalidades na função cognitiva, evidenciadas pela performance de atenção e percepção, memória, e tarefas espaciais, comparados com aqueles que ingeriram a dieta controle (10 mg de zinco por dia) (21).
Estão disponíveis poucas informações sobre o papel do zinco na função cognitiva de adultos mais velhos. Entretanto, em adultos de idade entre 65 e noventa anos, em um experimento realizado na Espanha, foi encontrada uma associação positiva entre a ingestão diária de zinco e a função cognitiva (2). Além disso, em mulheres mais velhas, os níveis sangüíneos de zinco um ano antes da morte estavam inversamente associados com o número de placas difusas e senis em seus cérebros (22). Obviamente existe a necessidade de se realizar experimentos bem controlados para se detectar com mais clareza o papel do zinco na cognição humana.
Ingestão de carne bovina e cognição
Considerando o efeito potencialmente benéfico do ferro e do zinco na performance cognitiva, é de interesse prático determinar se as fontes alimentícias destes nutrientes, como as carnes vermelhas (por exemplo, carne bovina) melhoram a cognição, particularmente em indivíduos com ou em alto risco de desenvolver deficiência de ferro e/ou zinco. Apesar de os dados sobre os efeitos da ingestão de carne bovina por humanos na cognição serem limitados, estudos com macacos reso indicam que o aumento da ingestão de ferro e zinco na forma de carne bovina ajuda a compensar os déficits cognitivos induzidos pelas deficiências destes nutrientes (17,23). Quando fêmeas de macacos reso foram moderadamente privadas de zinco e ferro durante o arranque no crescimento da adolescência, a participação nos testes comportamentais declinou. A carência de ferro-zinco em macacos é caracterizada por letargia, apatia e menor atividade motora espontânea. Entretanto, estas mudanças são revertidas ou prevenidas em alguma extensão através da inclusão de pastilhas de carne bovina em pó (isto é, adicionando, através disso, ferro e zinco) às dietas dos macacos por três meses (17,23).
Suprindo as necessidades de ferro e zinco
Dados de pesquisas nacionais de ingestão de alimentos indicam que, para muitos segmentos da população dos Estados Unidos, a ingestão de ferro e zinco está abaixo dos níveis diários recomendados (24). Escolhas alimentares pobres em nutrientes, incluindo baixa ingestão de produtos de origem animal, como carnes vermelhas, contribui para as deficiências destes nutrientes.
Produtos de origem animal, como as carnes, são as principais fontes de ferro e zinco biodisponíveis (25). De acordo com os últimos (1994) dados, os alimentos do Grupo Carnes contribuem com 16,3% do ferro e com 41,5% do zinco disponível no fornecimento de alimentos dos EUA. A carne sozinha contribui com 10,6% de ferro e com 30,4% de zinco disponível para consumo (25).
Em termos de ingestão real, uma pesquisa feita nos EUA com mais de 4,7 mil pessoas mostrou que o Grupo Carnes fornece 3,4 mg de ferro por dia e 5,3 mg de zinco por dia. Devido a seu alto teor de ferro e zinco, além da freqüência de ingestão, a carne bovina fornece quase 58% do ferro e 68% do zinco de todas as carnes (26). A carne bovina é uma das principais fontes de ferro e zinco (27,28). Tanto para crianças como para adultos a carne bovina foi identificada como a terceira fonte de ferro e a principal fonte de zinco em suas dietas (27,28).

Fonte: USDA, ARS. USDA Nutrient Database for Standard Reference, release13. Nutrient Data Laboratory homepage (www.nal.usda.gov/fnic/foodcomp). Dezembro de 2000.
1Alcatra: dados para bovinos de raças européias.
Publicado em: http://www.cnpgc.embrapa.br
Os alimentos do Grupo Carnes contêm heme ferro, que é mais rapidamente absorvido do que o ferro não heme encontrado em grãos, frutas, vegetais, ovos e produtos lácteos. O zinco é prontamente disponível a partir de carnes vermelhas (29,30). Em crianças pequenas, tem sido demonstrado que a absorção fracionária do zinco a partir de carne bovina é maior do que a de cereais (30). Alimentos típicos de crianças desmamadas são fortificados com ferro, mas com baixo teor de zinco. Por esta razão, a introdução de carnes, como carne bovina, como um suplemento para crianças com mais de seis meses que são amamentadas pode ajudar a suprir as necessidades tanto de ferro como de zinco (31).
A Pirâmide Alimentar do Departamento de Agricultura dos Estados Unidos (USDA) (32) recomenda que todos os norte-americanos saudáveis consumam de duas a três porções por dia (pelo menos 140 a 198 gramas) de alimentos do Grupo Carnes. Entretanto, para fornecer ingestões adequadas de zinco e ferro biodisponíveis, o consumo de carnes vermelhas é recomendado. As necessidades desses nutrientes são menos prováveis de serem supridas com carne de frango ou de peixe, ou feijão, em substituição às carnes vermelhas.
Referências bibliográficas
1.) Kretchmer, N.; Beard, J.L.; Carlson, S. The role of nutrition in the development of normal cognition. Am. J. Clin. Nutr. 63 (supp): 997s- 1001s; 1996.
2.) Ortega, R.M.; Requejo, A.M.; Andres, P.; Lopez-Sobalec, A.M.; Quintas, M.E.; Redondo, M.R.; Navia, B.; Rivas, T. Dietary intake and cognitive function in a group of elderly people. Am. J. Clin. Nutr. 66: 803-809; 1997.
3.) Kleinman, R.E.; Murphy, M.; Little, M.; Pagano, M.; Wehler, C.A.; Regal, K.; Jellinek, M.S. Hunger in children in the United States: potential behavioral and emotional correlates. Pediatrics 101: 1-6; 1998.
4.) Pollitt, E. Iron deficiency and cognitive function. Ann. Rev. Nutr. 13: 521-537; 1993.
5.) Sandstead, H.H.; Penland, J.G.; Alcock, N.W.; Dayal, H.H.; Chen, X.C.; Li, J.S.; Zhao, F.; Yang, J.J. Effects of repletion with zinc and other micronutrients on neuropsychologic performance and growth of Chinese children. Am. J. Clin. Nutr. 68 (supp): 470s-475s; 1998.
6.) National Cattlemen’s Beef Association. Iron, Zinc, Dietary Beef and Cognition. A Review of the Research. January 1999.
7.) Sandstead, H.H. Causes of iron and zinc deficiencies, and their effects on brain. J. Nutr. 130 (supp): 347S-349S; 2000.
8.) Pollitt, E. Developmental sequel from early nutritional deficiencies: conclusive and probability judgements. J. Nutr. 130 (supp): 350S- 353S; 2000.
9.) Lozoff, B.; Klein, N.K.; Nelson, E.C.; McClish, D.K.; Manuel, M.; Chacon, M.E. Behavior of infants with iron-deficiency anemia. Child. Develop. 69: 24-36; 1998.
10.) Idjradinata, P.; Pollitt, E. Reversal of developmental delays in iron-deficient anaemic infants treated with iron. Lancet 341: 1-4; 1993.
11.) Lozoff, B.; Wolf, A.; Mollen, E.; et. al. Functional significance of early iron deficiency. Pediatr. Res. 41: 15A; 1997.
12.) Roncagliolo, M.; Garrido, M.; Walter, T.; Peirano, P.; Lozoff, B. Evidence of altered central nervous system development in infants with iron deficiency anemia at 6 mos: delayed maturation of auditory brainstem responses. Am. J. Clin. Nutr. 68: 683-690; 1998.
13.) Pollitt, E. Iron deficiency and educational deficiency. Nutr. Rev. 55: 133-141; 1997.
14.) Bruner, A.B.; Joffe, A.; Duggan, A.K.; Casella, J.F.; Brandt, J. Randomized study of cognitive effects on iron supplementation in non-anemic iron-deficient adolescent girls. Lancet 348: 992-996; 1996.
15.) Tucker, D.M.; Penland, J.G.; Sandstead, H.H.; Milne, D.B.; Heck, D.G.; Klevay, L.M. Nutrition status and brain function in aging. Am. J. Clin. Nutr. 52: 93-102; 1990.
16.) Golub, M.S.; Keen, C.L.; Gershwin, M.E.; Hendrickx, A.G.Developmental zinc deficiency and behavior. J. Nutr. 125 (supp): 2263s-2271s; 1995.
17.) Golub, M.S.; Keen, C.L.; Gershwin, M.E. Moderate zinc-iron deprivation influences behavior but not growth in adolescent rhesus monkeys. J. Nutr. 130 (supp): 354S-357S; 2000.
18.) Penland, J.G. Behavioral data and methodology issues in studiesof zinc nutrition in humans. J. Nutr. 130 (supp): 361S-364S; 2000.
19.) Penland, J.; Sandstead, H.; Egger, N.; Dayal, H.; Alcock, N.; Plotkin, R.; Rocco, C.; Zavaleta, A. Zinc, iron and micronutrient supplementation effects on cognitive and psychomotor function of Mexican-American school children. FASEB J. 13: A921 (abst. 683.4); 1999.
20.) Darnell, L.S.; Sandstead, H.H. Iron, zinc, and cognition of women. Am. J. Clin. Nutr. 53: P-16; 1991.
21.) Penland, J.G. Cognitive performance effects of low zinc (Zn) intakes in healthy adult men. FASEB J. 5: A938; 1991.
22.) Tully, C.; Snowdon, D.; Markesbery, W. Serum zinc, senile plaques, and neurofibrillary tangles: findings from the Nun study.Neuroreport 6: 2105-2108; 1995.
23.) Golub, M.S.; Keen, C.L.; Gershwin, M.E. Behavioral andhematologic consequences of marginal iron-zinc nutrition in adolescent monkeys and the effect of a powdered beef supplement. Am. J. Clin. Nutr. 70:1059-1068; 1999.
24.) U.S. Department of Agriculture, Agricultural Research Service. Data tables; Results from USDA’s 1994-96 Continuing Survey of Food Intakes by Individuals and 1994-96 Diet and Health Knowledge Survey, [Online]. ARS Food Surveys Research Group. December 1997. <http://www.barc.usda.gov/bhnrc/foodsurvey/home.htm>
25.) Gerrior, S.; Bente, L. Nutrient content of the U.S. Food Supply, 1909-94. Home Economics Research Report No. 53. U.S. Department of Agriculture, Center for Nutrition Policy and Promotion, 1997.
26.) National Live Stock and Meat Board. Eating in America Today. A Dietary Pattern and Intake Report Commissioned by the National Live Stock and Meat Board. Edition II. Chicago, IL: National Live Stock and Meat Board; 1994.
27.) Subar, A.F.; Krebs-Smith, S.M.; Cook, A.; Kahle, L.L. Dietary sources of nutrients among US adults, 1989 to 1991. J. Am. Diet. Assoc. 98: 537-547; 1998.
28.) Subar, A.F.; Krebs-Smith, S.M.; Cook, A.; Kahle, L.L. Dietary sources of nutrients among US children, 1989-1991. Pediatrics 102: 913-923; 1998.
29.) Zheng, J.J.; Mason, J.B.; Rosenberg, I.H.; et. al. Measurement of zinc bioavailability from beef and a ready-to-eat high-fiber breakfast cereal in humans: application of a whole-gut lavage technique. Am. J. Clin. Nutr. 58: 902-907; 1993.
30.) Jalla, S.; Steirn, M.E.; Miller, L.V.; Krebs, N.F. Comparison of zinc absorption from beef vs iron fortified rice cereal in breast-fed infants. FASEB J. 12(4): A 346 (2010); 1998.
31.) Krebs, N.F. Dietary zinc and iron sources, physical growth and cognitive development of breastfed infants. J. Nutr. 130 (supp): 358S- 360S; 2000.
32.) U.S. Department of Agriculture. The Food Guide Pyramid. Home and Garden Bulletin No. 252. Hyattsville, MD: USDA, Human Nutrition Information Service; 1992.
33.) Center for Nutrition Policy and Promotion, U.S. Department of Agriculture. The Healthy Eating Index. Washington, DC: Office of Communications; 1995.
34) http://www.cnpgc.embrapa.br/publicacoes/divulga/GCD41.html
Fonte: National Cattlemen’s Beef Association



0 Comments
Este artigo está muito bem fundamentado na parte técnica.
Acho que este tipo de informação ainda é muito pouco explorada pelo marketing da cadeia, penso que ao lado do sentido ecológico do nosso sistema de produção que é na sua maioria à pasto, deva ser o foco principal para propagar o consumo da carne vermelha.